Kompaktlexikon der Biologie: Phytochrome
Phytochrome, eine Gruppe von pflanzlichen Fotorezeptoren, die als Rotlichtrezeptoren die Fotomorphogenese, d.h. die Entwicklungs- und Stoffwechselprozesse in Abhängigkeit von Licht regulieren. So reicht ein einziger, relativ schwacher Lichtblitz aus, um bei einem etiolierten Keimling (Etiolement) die für das Ergrünen von Pflanzen typischen Prozesse auszulösen: reduziertes Streckungswachstum, Öffnen des Hypokotylhakens sowie einsetzende Chlorophyllsynthese. Die biologische Rolle der P. wurde in den 1930er-Jahren erstmals nachgewiesen, als die Keimung von Samen des Lichtkeimers Salat in Abhängigkeit von hellrotem (650 – 680 nm) und dunkelrotem Licht (710 – 740 nm) untersucht wurde. Es stellte sich heraus, dass die Keimung durch Hellrot gefördert und durch Dunkelrot inhibiert wurde. Im Jahr 1952 folgerten amerikanische Wissenschafter aus ihren experimentellen Daten, dass Phytochrome als zwei ineinander überführbare Formen existieren müssen. Indem sie Salatsamen abwechselnd mit hell- und dunkelrotem Licht bestrahlt hatten, konnten sie zeigen, dass die Keimung immer dann stattfand, wenn die letzte Lichtgabe Rotlicht war. Phytochrome existieren somit als so genannte Hellrot-absorbierende Form (Pr) und Dunkelrot-absorbierende Form (Pfr, fr = engl. far red), die fotoreversible Reaktionen hervorrufen können ( vgl. Abb. ).
Natives P. ist ein Homodimer, das aus zwei Polypeptidketten besteht mit einem Molekulargewicht von ca. 250 kDa. Jede der Untereinheiten besteht aus zwei Komponenten, einem Phytochrombilin genannten linearen Tetrapyrrol als Chromophor und dem Apoprotein. Beide sind über eine Thioesterbrücke des Proteins miteinander verbunden. Interessanterweise wird das Phytochrombilin in den Plastiden synthetisiert und gelangt anschließend vermutlich passiv in das Cytosol, wo es sich mit dem Apoprotein zum Holoprotein vereinigt. P. zeichnen sich durch zwei funktional verschiedene Domänen aus, die scharnierartig miteinander verbunden sind. In der N-terminalen Domäne befindet sich die Chromophor-Bindestelle; sie ist somit für die fotosensorischen Eigenschaften verantwortlich. Die C-terminale Domäne ist als regulatorische Region hingegen für die Weiterleitung des Lichtsignals verantwortlich.
Die lichtinduzierte Fotokonversion vom physiologisch inaktiven Pr zum physiologisch aktiven Pfr erfolgt durch eine cis-trans-Isomerisierung am Kohlenstoffatom C15, wodurch eine Konformationsänderung im Apoprotein hervorgerufen wird.
Phytochromeffekte. P. sind in Pflanzen für vielfältige Reaktionen verantwortlich, die sich in schnelle biochemische bzw. molekularbiologische Prozesse und langsamere physiologische Reaktionen untergliedern lassen. So können P. schnell Membranpotenziale und Ionenkanäle regulieren und die Produktion von bestimmten Substanzen wie z.B. Anthocyanen und Chlorophyll induzieren. Des weiteren reguliert P. die Expression zahlreicher Gene. Zu den physiologischen Prozessen zählen neben der Samenkeimung die Bildung von Blättern, die Kontrolle der Blütenbildung oder die Förderung des Wachstums. Dabei beeinflusst die Lichtmenge die Art und Weise des physiologischen Effektes ( vgl. Abb. ). Eine äußerst geringe Lichtmenge im Bereich von unter 1 μmolm2– reicht aus, um z.B. bei Arabidopsis thaliana die Samenkeimung auszulösen (VLFR = very low fluence response). P.-induzierte Reaktionen, die Rotlicht bis zu 1000 μmolm2– benötigen, werden als low fluence rate (LFR) bezeichnet; sie ist für die meisten der klassischen fotoreversiblen P.-Effekte verantwortlich. Längere und kontinuierliche Bestrahlung mit hohen Lichtintensitäten (HIR = Hochintensitätsreaktion) führen zu einer Reihe von Fotomorphogenese-Reaktionen wie z.B. der Inhibition des Hypokotylwachstums oder der Öffnung des Apikalhakens.
P. ermöglichen Pflanzen, sich auf verändernde Lichtverhältnisse einzustellen, da das Verhältnis von Hellrot- zu Dunkelrotlicht im Tageslicht und an unterschiedlichen Standorten verschieden ist. So ist volles Sonnenlicht Hellrot-angereichert, wohingegen Standorte unterhalb eines Pflanzendaches durch Dunkelrot-angereichtes Licht gekennzeichnet sind.
Molekularbiologie der P.-Effekte. Die Untersuchung von P. ergab,dass bei Arabidopsis thaliana eine aus fünf Genen bestehende Genfamilie vorhanden ist, die die Gene PHYA, PHYB, PHYC, PHYD und PHYE unfasst. Ihre Funktion konnte durch die Analyse von P.-Mutanten genauer untersucht werden. Zu ihnen zählen die so genannten hy-Mutanten von Arabidopsis thaliana, die sich durch das Vorhandensein eines langen Hypokotyls in Anwesenheit von Licht auszeichnen, weil einige von ihnen einen Defekt in der Chromophorbiosynthese aufweisen. Dabei stellte sich heraus, dass PHYA und PHYB unterschiedliche Funktionen haben, die sich zueinander antagonistisch verhalten. Die De-Etiolierung hängt von den durch den Anteil an Rot- und Dunkelrotlicht kontrollierten Mengenverhältnissen von P. A und P. B ab ( vgl. Abb. ). P. sind an der Regulation der Genexpression zahlreicher im Nucleus codierter lichtregulierter Gene beteiligt, die in ihren Promotoren bestimmte konservierte Sequenzmotive (z.B. so genannte GT-1-Regionen, I-Boxen oder G-Boxen) aufweisen. Zu den ersten Genen, deren Expression mit P. in Verbindung gebracht wurden, waren die an der Fotosynthese beteiligten Gene der Chlorophyll a/b-bindenden Proteine und der kleinen Untereinheit des Enzyms Ribulose-1,5-bisphosphat-Carboxylase/Oxygenase. Auch die Expression von PHYA ist lichtreguliert. An der Umsetzung des durch P. wahrgenommenen Lichtes sind zahlreiche Faktoren beteiligt: So wurden als second messenger G-Proteine, cGMP sowie das Calcium/Calmodulin-System nachgewiesen. Eine Reihe von weiteren Proteinen (DET, COP), deren Mutation zu einer veränderten Fotomorphogenese führt, sind ebenfalls an der P.-Signaltransduktionskette beteiligt. Interessanterweise sind P. auf molekularer Ebene auch am Fotoperiodismus beteiligt, indem sie z.B. die Synchronisation der inneren Uhr bewirken. Deshalb wirken sich Mutationen einzelner P.-Gene auch auf die Blühinduktion aus. Die Blütenbildung wird dabei in unterschiedlicher Weise durch Rot bzw. Dunkelrot kontrolliert, je nachdem, ob es sich um Kurztag- oder Langtagpflanzen handelt.
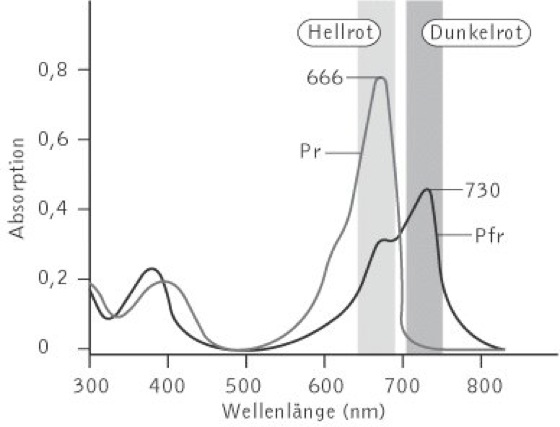
Phytochrome: Absorptionsspektren von Pr und Pfr
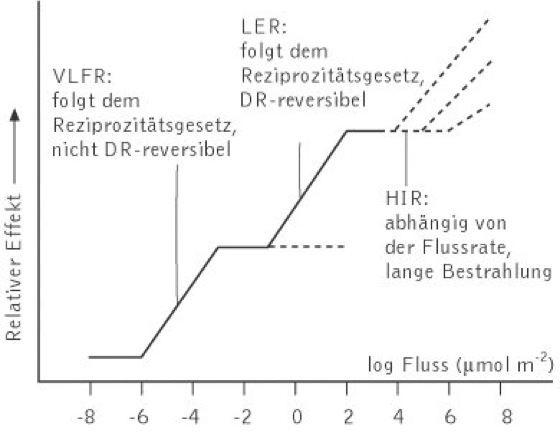
Phytochrome: Die drei Typen der Phytochromreaktionen in Abhängigkeit steigender Bestrahlung mit hellrotem Licht. Abkürzungen siehe Text. Bei der HIR sind drei verschiedene Strahlungsintensitäten dargestellt

Phytochrome: Regulation der Expression von Phytochrom-Genen mit deutlichen Unterschieden zwischen PHYA und PHYB – PHYE. Bei PHYA sind drei Faktoren wirksam, um den Gehalt dieses Phytochroms zu kontrollieren: Repression der Genregulation durch Pfr, Abbau des Proteins durch das Ubiqitin (Ub)-System und Abbau der mRNA. Die anderen Phytochrome werden nicht durch Pfr reguliert. Proteine und Transkripte sind zudem stabiler

Phytochrome: Antagonistische Wirkung der Phytochrome A und B. a Rolle von hellrotem und dunkelrotem Dauerlicht bei der De-Etiolierung eines Keimlings. b Einfluss von Phytochrom A und B auf die Entwicklung von Keimlingen bei unterschiedlichen Lichtverhältnissen. Bei voller Bestrahlung mit einem hohen Rotlichtanteil ist Phytochrom B für die De-Etiolierung verantwortlich (links). Unter einer Blätterschicht kommt es zunächst durch die Wirkung von Phytochrom A zur De-Etiolierung (Mitte). Da dieses labil ist, wird durch Einfluss von Phytochrom B die Hemmung des Sprosswachstums aufgehoben (Schattenfluchtreaktion, rechts)








Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.