News: Faltung wahren
Prionen verwandeln die Gehirne von Mensch und Tier in schwammartige Gebilde. Doch wie vermehren sich infektiöse Eiweiße, die anscheinend keinerlei Erbsubstanz zur Vermehrung besitzen?

© Adriano Aguzzi/Cell (Ausschnitt)
Prionen (proteinaceous infectious particles) sind nicht nur die Ursache so genannter spongiformer Gehirnfunktionsstörungen bei Mensch und Tier, sie bereiten auch Wissenschaftlern seit Jahren Kopfschmerzen.
Schon allein die Entdeckung von Proteinen, die durch eine Umfaltung ihrer Aminosäureketten krankheitserregend und noch dazu übertragbar sind, stellte in den achtziger Jahren die bisherigen Erkenntnisse der Infektionsbiologie auf den Kopf. Bei den durchgeführten Notschlachtungen stießen Wissenschaftler schließlich auf die Erreger des "Rinderwahnsinns" (BSE), die beim Menschen vermutlich zu der neuen Variante der Creutzfeldt-Jakob-Krankheit (vCJD) führen. Die "falsch-gefalteten" Proteine verklumpen in Gehirn und Rückenmark zu Plaques, sodass die Nervenzellen der infizierten Menschen und Tiere absterben und sich deren Hirnrinde schwammartig verändert.
Doch es sollte noch rätselhafter kommen. Denn Prionen besitzen anscheinend keinerlei Erbsubstanz, also Nucleinsäuren wie DNA oder RNA, um sich überhaupt vermehren und übertragen zu können – und tun es trotzdem.
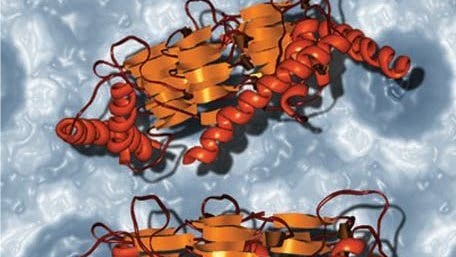
Stanley Prusiner vermutete als erster, dass Prionen sich vervielfältigen, indem sie ihre anormale Faltung auf andere Proteine "übertragen", und erhielt für diese Hypothese 1997 den Nobelpreis für Medizin oder Physiologie. Prionen sind demzufolge eine umgefaltete Form des Proteins PrPC, das an Zellaußenseiten von Säugern und Vögeln zu finden ist. Laut Prusiners Hypothese kann sich das "missgefaltete", als PrPSc bezeichnete Prion an das zelluläre PrPC-Prion-Protein mit normaler Struktur anlagern und so dessen Umfaltung in das krankheitsauslösende Prion herbeiführen.
Dass dem tatsächlich so ist, wollen die Wissenschaftler um Adriano Aguzzi vom University Hospital Zurich jetzt nachgewiesen haben. Sie veränderten das Erbgut von Mäusen, sodass diese nicht das übliche Membranprotein PrPC, sondern ein lösliches Doppel-Molekül, oder auch Dimer, des normal gefalteten Prionen-Proteins produzierten. Mit Hilfe eines zusätzliches Antikörper-Bruchstückes, das die Forscher mit der künstlichen PrPC-Variante gentechnisch verknüpften, konnten sie die künstlichen Prionen-Proteine wieder aus den Gewebe-Extrakten herausfischen – mitsamt allem, was sonst noch daran bindet.
Eine Infektion der Versuchsmäuse mit infektiösen Prionen bestätigte schließlich die Erwartung der Wissenschaftler: Die krankheitserregenden Prionen hatten sich an die künstlichen PrPC-Dimere angelagert, welche die Forscher aus dem Gehirn-Extrakten der Mäuse isolierten.
Der "bislang eindeutigste Beweis", äußert sich Prionen-Forscher Michael Scott der University of California in San Francisco begeistert, "denn hier wurden die natürlichen Bedingungen nachgestellt."
Doch nicht nur der gelungene Nachweis der Prionen-Wechselwirkungen freut die Forscher. Auch gegen die Umfaltung, die normalerweise durch die falsch-gefalteten Prionen eingeleitet wird, schienen ihre künstlichen, normal gefalteten Ebenbilder resistent zu sein. Denn bei Mäusen, die das künstliche PrPC-Dimer produzierten, verzögerte sich der Ausbruch der Krankheit um mehr als drei Monate gegenüber den genetisch nicht veränderten Tieren nach einer Prionen-Infektion. Die künstlichen Prionen-Proteine blockierten demnach ihre infektiösen Duplikate.
Die vermehrungshemmenden Wirkung des künstlichen Prionen-Komplexes stimmt Aguzzi und seine Kollegen optimistisch. Künstliche Prionen könnten der Grundstein für eine neue Therapie zur Behandlung der neuen Variante der Creutzfeldt-Jakob-Krankheit sein, hofft das Forscher-Team. In Zukunft wollen sie testen, ob sich der Krankheitsverlauf von vCJD durch künstliche Prionen hinauszögern lässt.
Schon allein die Entdeckung von Proteinen, die durch eine Umfaltung ihrer Aminosäureketten krankheitserregend und noch dazu übertragbar sind, stellte in den achtziger Jahren die bisherigen Erkenntnisse der Infektionsbiologie auf den Kopf. Bei den durchgeführten Notschlachtungen stießen Wissenschaftler schließlich auf die Erreger des "Rinderwahnsinns" (BSE), die beim Menschen vermutlich zu der neuen Variante der Creutzfeldt-Jakob-Krankheit (vCJD) führen. Die "falsch-gefalteten" Proteine verklumpen in Gehirn und Rückenmark zu Plaques, sodass die Nervenzellen der infizierten Menschen und Tiere absterben und sich deren Hirnrinde schwammartig verändert.
Doch es sollte noch rätselhafter kommen. Denn Prionen besitzen anscheinend keinerlei Erbsubstanz, also Nucleinsäuren wie DNA oder RNA, um sich überhaupt vermehren und übertragen zu können – und tun es trotzdem.
Stanley Prusiner vermutete als erster, dass Prionen sich vervielfältigen, indem sie ihre anormale Faltung auf andere Proteine "übertragen", und erhielt für diese Hypothese 1997 den Nobelpreis für Medizin oder Physiologie. Prionen sind demzufolge eine umgefaltete Form des Proteins PrPC, das an Zellaußenseiten von Säugern und Vögeln zu finden ist. Laut Prusiners Hypothese kann sich das "missgefaltete", als PrPSc bezeichnete Prion an das zelluläre PrPC-Prion-Protein mit normaler Struktur anlagern und so dessen Umfaltung in das krankheitsauslösende Prion herbeiführen.
Dass dem tatsächlich so ist, wollen die Wissenschaftler um Adriano Aguzzi vom University Hospital Zurich jetzt nachgewiesen haben. Sie veränderten das Erbgut von Mäusen, sodass diese nicht das übliche Membranprotein PrPC, sondern ein lösliches Doppel-Molekül, oder auch Dimer, des normal gefalteten Prionen-Proteins produzierten. Mit Hilfe eines zusätzliches Antikörper-Bruchstückes, das die Forscher mit der künstlichen PrPC-Variante gentechnisch verknüpften, konnten sie die künstlichen Prionen-Proteine wieder aus den Gewebe-Extrakten herausfischen – mitsamt allem, was sonst noch daran bindet.
Eine Infektion der Versuchsmäuse mit infektiösen Prionen bestätigte schließlich die Erwartung der Wissenschaftler: Die krankheitserregenden Prionen hatten sich an die künstlichen PrPC-Dimere angelagert, welche die Forscher aus dem Gehirn-Extrakten der Mäuse isolierten.
Der "bislang eindeutigste Beweis", äußert sich Prionen-Forscher Michael Scott der University of California in San Francisco begeistert, "denn hier wurden die natürlichen Bedingungen nachgestellt."
Doch nicht nur der gelungene Nachweis der Prionen-Wechselwirkungen freut die Forscher. Auch gegen die Umfaltung, die normalerweise durch die falsch-gefalteten Prionen eingeleitet wird, schienen ihre künstlichen, normal gefalteten Ebenbilder resistent zu sein. Denn bei Mäusen, die das künstliche PrPC-Dimer produzierten, verzögerte sich der Ausbruch der Krankheit um mehr als drei Monate gegenüber den genetisch nicht veränderten Tieren nach einer Prionen-Infektion. Die künstlichen Prionen-Proteine blockierten demnach ihre infektiösen Duplikate.
Die vermehrungshemmenden Wirkung des künstlichen Prionen-Komplexes stimmt Aguzzi und seine Kollegen optimistisch. Künstliche Prionen könnten der Grundstein für eine neue Therapie zur Behandlung der neuen Variante der Creutzfeldt-Jakob-Krankheit sein, hofft das Forscher-Team. In Zukunft wollen sie testen, ob sich der Krankheitsverlauf von vCJD durch künstliche Prionen hinauszögern lässt.



Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.