Mechanische Biologie: Die Kräfte, die uns formen
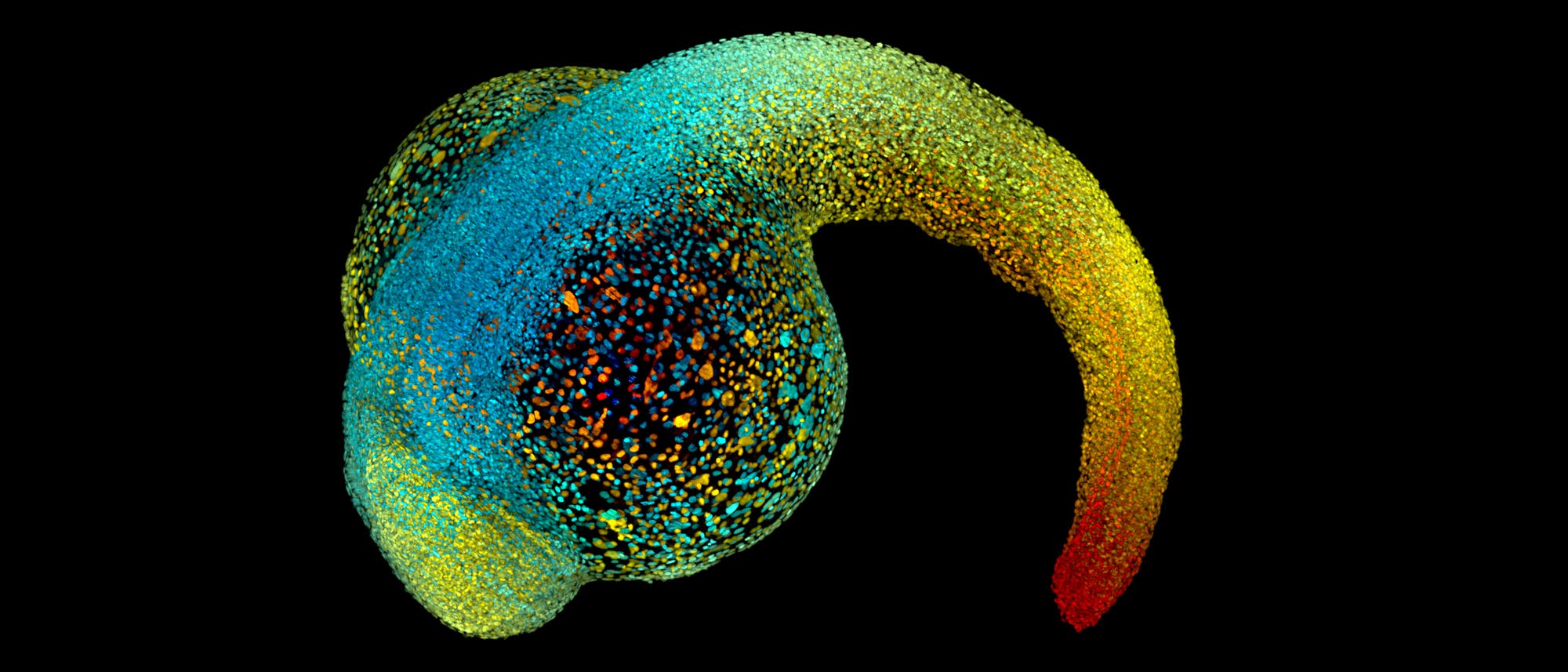
Am Anfang hat ein Embryo weder Vorder- noch Rückseite, weder Kopf noch Füße. Er besteht einfach nur aus einer Kugel aus Zellen. Doch schon bald beginnt sich dieser zunächst gleichförmige Zellhaufen zu verändern. In der Mitte der Kugel sammelt sich Flüssigkeit. Die Zellen bewegen sich, sie fließen in der Kugel umher, um ihre Positionen im zukünftigen Körper einzunehmen. Zellschichten falten sich wie ein Origami und bilden ein Herz, einen Darm, ein Gehirn.
Nichts von alledem könnte geschehen, wenn nicht eine Kraft das wachsende Lebewesen quetscht, biegt und in Form zieht – und das bis ins Erwachsenenalter hinein. Diese Kräfte gehen dabei von anderen Zellen im Körper aus und von ihrem Umfeld.
Die Entwicklungsbiologin Amy Shyer erforscht an der Rockefeller University in New York City die so genannte Morphogenese – die Art und Weise, wie Körper und Gewebe ihre Form annehmen – und hält sie für »eine der wichtigsten und immer noch schlecht verstandenen Fragen unserer Zeit«. Jahrzehntelang haben sich Biologen darauf konzentriert, wie Gene und andere Biomoleküle unseren Körper formen – was aber auch daran lag, dass die Methoden stets ausgereifter wurden, die für genau solche Untersuchungen nötig sind. Deutlich weniger Aufmerksamkeit wurde dabei der Rolle von mechanischen Kräften geschenkt, der Domäne der Fachrichtung Mechanobiologie.
Mechanische Kräfte wurden unterschätzt
Nur Gene und Biomoleküle zu betrachten, das ist so, »als würde man versuchen, ein Buch mit nur der Hälfte der Buchstaben des Alphabets zu schreiben«, sagt Xavier Trepat, ein Mechanobiologe am Institut für Bioengineering von Katalonien in Barcelona. Seit etwa 20 Jahren wächst die Szene der Mechanobiologen: Wissenschaftler beginnen, der Bedeutung der Mechanik in allerlei Entwicklungsstadien, Organen und Organismen Aufmerksamkeit zu schenken. Forscher untersuchen, wie Zellen Kräfte wahrnehmen, wie sie darauf reagieren und wie sie sie selbst erzeugen. Der Forschungszweig hat maßgeschneiderte Werkzeuge hervorgebracht, die unter anderem Laser und Mikropipetten, magnetische Partikel und speziell angefertigte Mikroskope nutzen.
Die meisten Wissenschaftler erforschen mechanische Signale in Zellen oder Geweben, die in einer Petrischale kultiviert wurden. Einige wenige untersuchen aber auch ganze Tiere und stoßen dabei gelegentlich auf Wirkmechanismen, die sich von denen unterscheiden, die in isolierten Geweben im Labor beobachtetet werden. In-vivo-Studien wie diese stellen Forschern manche hohe Hürden in den Weg – zum Beispiel, minimale Kräfte in komplexen Gewebestrukturen messen zu müssen –, sie sind jedoch essenziell, wenn man die Rolle von mechanischer Kraft bei Formungsprozessen des Lebens verstehen will, sagt Roberto Mayor, ein Entwicklungsbiologe am University College London.
Auf lange Sicht könnten die dabei gewonnenen Erkenntnisse Wissenschaftlern dann auch helfen, bessere Behandlungsmöglichkeiten für andere Probleme zu entwickeln – etwa bei Unfruchtbarkeit oder Krebs. Denn »Kräfte wirken überall dort, wo eine dreidimensionale Form im Spiel ist«, sagt Thomas Lecuit, ein Entwicklungsbiologe am Institut für Entwicklungsbiologie in Marseille – sie wirken also immer.
Zellen werden auseinandergebrochen
Aus Sicht der Forscher wirken die Kräfte gelegentlich auf unerwartete Weise. Ein Team von Entwicklungsbiologen um Jean-Léon Maître vom Curie Institute in Paris hatte zum Beispiel den sehr frühen Entwicklungsprozess eines Embryos im Detail abzubilden versucht: jene Phase, in der der ungeformte Ball der ersten Zellen zu einer Art Blase mit einem großen, flüssigkeitsgefüllten Hohlraum wird, dem Lumen. In diesem Raum werden in einem ersten symmetriebrechenden Ereignis jene Zellen, aus denen sich der Fötus entwickeln wird, auf einer Seite zusammengeschoben. Dadurch wird unter anderem festgelegt, welche Seite des wachsenden Lebens der Rücken und welche der Bauch sein wird. Aber wie bildet der Embryo das Lumen? Und was bestimmt, welche Zellen wo landen?
Maître und seine Kollegen sahen beim Blick auf den Embryo »kleine Bläschen, kleine Wassertaschen, die sich zwischen den Zellen bilden«, sagt der Entwicklungsbiologe. »Sie sind flüchtig, man verpasst sie, wenn man nicht schnell genug fotografiert.« Die Flüssigkeit in diesen Bläschen stammt aus der Umgebung des Embryos und wird in den Zellhaufen von außen – wo der Wasserdruck höher ist – hineingepresst. Zudem sickert das Wasser dieser Täschchen durch Lücken zwischen den Zellen und sammelt sich im Bereich des entstehenden Lumens.
Die Forscher beobachteten, dass die Bläschen dabei die typischen Proteinverbindungen zwischen Zellen kappten: Mit der Ankunft der Bläschen scheinen Adhäsionsproteine auseinanderzubrechen, und die Zellen werden auseinandergeschoben. Dabei bleibt bislang unklar, wieso im Embryo Zellverbindungen rabiat unterbrochen werden. Das scheine, sagt Maître, »definitiv ineffizient und riskant zu sein«. Aber womöglich ist die Strategie auch als die beste Lösung für das Problem entstanden, schlicht, weil sie »gut genug« ist. Maître hofft, dass ein besseres Verständnis der mechanischen embryonalen Prozesse unter anderem Kliniken bei der In-vitro-Fertilisation helfen könnte, die Embryonen zu identifizieren, die für eine erfolgreiche Schwangerschaft implantiert werden sollen.
Später in ihrer Entwicklung bilden die Embryonen Kopf und Schwanz aus und brechen damit die Symmetrie in einer weiteren Ebene. Otger Campàs, ein Biophysiker an der University of California, Santa Barbara, vhat mit seiner Forschergruppe den Prozess des Schwanzwachstums bei Embryonen des Zebrafisches (Danio rerio) verfolgt. Die beteiligten Kräfte maßen sie mit Öltröpfchen, die mit magnetischen Nanopartikeln beladen waren und in die Zellzwischenräume injiziert wurden. Dann legten die Forscher ein Magnetfeld an, um die Tröpfchen zu verformen, so dass sie messen konnten, wie das Gewebe auf die Kraft reagierte.
Seltsame Transformation von flüssig zu fest
Sie fanden heraus, dass sich die Spitze des wachsenden Schwanzes in einem Zustand befand, den Physiker »flüssig« nennen – die Zellen flossen frei, und wenn man sie drückte, verformte sich das Gewebe leicht. Je weiter sich die Wissenschaftler vom Schwanzende entfernten, desto starrer wurde das Gewebe. »Wir wussten, dass es sich verfestigte, aber wir kannten den Mechanismus nicht«, erinnert sich Campàs.
Zwischen den Zellen gab es nichts, was die Steifigkeit erhöhen könnte, also keine Moleküle. Als die Forscher jedoch die Zwischenräume zwischen den Zellen maßen, waren diese in der weichen Schwanzspitze größer als in der Nähe des Kopfes. Als sich die Zellen zusammendrängten, verfestigte sich das Gewebe. Campàs vergleicht den Übergang mit vakuumverpacktem Kaffeepulver: Die einzelnen kleinen Körner fließen frei in eine Tüte, werden aber so dicht gepackt, dass sich die gefüllte Tüte wie ein Ziegelstein anfühlt. Er plant zu untersuchen, ob jener Mechanismus auch die Grundlage weiterer embryonaler Strukturen darstellt.
»Wir wissen nur wenig darüber, wie sich ein inneres Organ bildet«Timothy Saunders, Entwicklungsbiologe
Später, nach der ersten Phase der Entwicklung, beginnen sich im Embryo einzelne Organe zu bilden. »Wir wissen nur wenig darüber, wie sich ein inneres Organ bildet«, sagt Timothy Saunders, Entwicklungsbiologe an der National University of Singapore. Die einzige Ausnahme sei der Darm. Das beginnt sich zu ändern. Saunders' Gruppe untersuchte zum Beispiel die Bildung des Herzens in Embryonen der Fruchtfliege Drosophila. Es gibt dabei ein entscheidendes Ereignis: Zwei Gewebestücke bilden eine Röhre, aus der schließlich das Herz wird. Jedes Stück enthält zwei Arten von Herzmuskelzellen. Damit ein gesundes Herz entstehen kann, müssen sich die Teile richtig zusammenfügen: Die jeweils passenden Zellen müssen zueinanderfinden. »Wir haben oft zunächst eine Fehlstellung gesehen, die dann korrigiert wurde«, sagt Saunders. »Was hat die Korrektur verursacht?«
Es stellte sich heraus, dass es eine Kraft aus dem Inneren der Herzzellen selbst ist. Die Forscher wussten bereits, dass ein Protein namens Myosin II – ein naher Verwandter des Proteins, das Muskelzellen kontrahieren lässt – während der Bildung des Herzens von der Mitte jeder Zelle zu ihrem Rand hin und her fließt. Der damalige Doktorand Shaobo Zhang – der sich jetzt auf eine Postdocstelle an der University of California vorbereitet – fragte sich, ob das Myosin dadurch eine Kraft erzeugen könnte, die an den gepaarten Zellen zerrt und so die Verbindung zwischen den nicht zusammenpassenden Typen unterbricht.
Um seine Theorie zu testen, zerschnitt Zhang die gepaarten Zellen mit einem Laser. Die Zellen zischten auseinander wie ein gespanntes Gummiband, das mit einer Schere durchgeschnitten wird. »Wir konnten einen schönen Rückstoß sehen«, sagt Saunders. Aber als das Team Zellen ohne Myosin II auseinanderschnitt, »passierte einfach nichts«. Das Myosin erzeugte die Kraft, um an den Verbindungen von innen zu zerren – man kann sich das vorstellen wie Finger, die ein Gummiband auseinanderziehen. Unpassende Zellen mit gekappten Verbindungsankern haben dann eine neue Chance, die richtigen Partner zu finden.
Woher wissen Zellen, wo sie hingehören?
Auch eine einfache Zellvermehrung kann den Zellen signalisieren, sich richtig zu arrangieren, wie Forscher der britischen University of Cambridge bei Embryonen des Krallenfrosches Xenopus entdeckten. Das Team um den Biophysiker Kristian Franze wusste bereits, dass die Augenneuronen bei der Verkabelung von Auge und Gehirn ihre Axone – das sind lange Fortsätze, durch die Neuronen miteinander in Kontakt treten – entlang eines Weges anordnen, der durch die Steifigkeit des Hirngewebes definiert ist. Die Axone des Auges folgen weicheren Geweben zu einem zentralen Knotenpunkt im sich entwickelnden Gehirn.
Um herauszufinden, wann und wie sich dieser Weg bildet, baute das Team ein Mikroskop, mit dem es den Prozess in vivo beobachten konnten, während die Forscher gleichzeitig die Steifigkeit des Gewebes mit einer winzigen Sonde maßen. Die Steifigkeit erhöhte sich etwa 15 Minuten bevor die Axone dort ankommen, wo ihnen durch die Steifigkeit der Weg gebahnt wird, sagt Franze, der auch das Institut für Medizinische Physik und Mikrogewebetechnik an der Universität Erlangen-Nürnberg in Deutschland leitet.
Wie bei den sich entwickelnden Zebrafischschwänzen schien das steifere Gewebe in den Froschgehirnen eine größere Dichte an Zellen zu enthalten. Als das Team die Zellteilung in den sich entwickelnden Embryonen blockierte, veränderte sich die Steifigkeit nicht – und die Axone konnten ihren Weg nicht finden. Einen Raum mit Zellen zu füllen, scheint ein schneller und effektiver Weg zu sein, um die Verdrahtung des Nervensystems zu steuern.
Wie vermehren sich Hautzellen?
Auch voll entwickelte Tiere haben mit mechanischen Kräften zu tun, wenn sie weiter wachsen oder mit Krankheiten kämpfen. Dehnt sich zum Beispiel ein Körper aus, wächst die Haut, um ihn zu bedecken. Chirurgen machen sich dies bei der Brustrekonstruktion zu Nutze, wenn mehr Haut benötigt wird, um das geplante Implantat zu bedecken. Zunächst setzen sie einen »Ballon« ein und blasen ihn über Monate hinweg allmählich mit Kochsalzlösung auf, wodurch die vorhandene Haut gedehnt wird, bis genug neue Haut gewachsen ist, um sie in einer zweiten Operation zu verwenden.
Aber wieso und wie genau reagieren die Hautzellen auf solchen Druck und vermehren sich? Mit dieser Frage beschäftigte sich die Stammzellbiologin Mariaceleste Aragona als Postdoc an der Université Libre de Bruxelles in Belgien in Zusammenarbeit mit Cédric Blanpain. Sie implantierte Mäusen ein Kügelchen eines selbstexpandierenden Hydrogels unter die Haut. Während das Hydrogel Flüssigkeit aufnahm, dehnte sich die umgebende Haut. Bereits einen Tag nach der Implantation des Hydrogels konnte Aragona beobachten, dass sich die Stammzellen unter der äußeren Hautschicht zu vermehren begannen und so das Rohmaterial für die Differenzierung zu neuer Haut lieferten.
»Steifheit macht Krebszellen bösartiger«Xavier Trepat, Mechanobiologe
Aber: Nicht alle Stammzellen vermehrten sich als Reaktion auf die Dehnung. Nur eine bisher nicht definierte Subpopulation begann, neue Stammzellen zu produzieren. »Wir wissen immer noch nicht warum«, sagt Aragona, die jetzt an der Universität von Kopenhagen arbeitet. Das Verständnis dieses Systems könnte zu Methoden führen, um das Hautwachstum für chirurgische Rekonstruktionen oder die Wundheilung zu fördern, fügt Blanpain hinzu.
Die mechanischen Eigenschaften von Geweben spielen ebenfalls eine Rolle bei abnormalem Zellwachstum, wie zum Beispiel bei Krebs. »Solide Tumoren sind steifer als normales Gewebe«, sagt Trepat. Das liegt zum Teil an einem Übermaß an faserigem Geflecht, der so genannten extrazellulären Matrix, die die Zellen umgibt, aber auch daran, dass die Krebszellen selbst proliferieren, sagt er. »Steifheit macht Krebszellen bösartiger«, fügt Trepat hinzu. Wenn Wissenschaftler verstehen könnten, warum, sagt er, könnten sie vielleicht Behandlungen entwickeln, die diese physikalischen Eigenschaften verändern und Krebserkrankungen weniger gefährlich machen.
In einer verwandten Studie haben Forscher der Rockefeller University mechanische Kräfte identifiziert, die erklären, warum manche Hautkrebse gutartig und andere bösartig sind. Aus Hautstammzellen entstehen zwei verschiedene Arten von Krebs: Basalzellkarzinome, die sich nicht über die Haut hinaus ausbreiten, und invasive Plattenepithelkarzinome. Beide drücken auf die darunter liegende Basalmembran, eine Schicht aus Strukturproteinen, die die äußeren Schichten der Haut vom tieferen Gewebe trennt. Der gutartige Basalzelltumor durchbricht die Basalmembran nur selten, aber sein aggressiveres Gegenstück durchquert das Gefäßsystem oft, um sich in anderen Teilen des Körpers festzusetzen.
Bei der Arbeit mit Haut von Mäusen entdeckten die Stammzellbiologen Elaine Fuchs und Vincent Fiore, dass der gutartige Krebs eine dickere, weichere Basalmembran bildete, die die Tumorzellen wie ein Handschuh umschloss, wenn sie nach unten drückten. Der aggressive Tumor hingegen förderte eine dünnere Basalmembran. Auch eine Kraft von oben half den invasiven Tumoren: Plattenepithelkarzinome bilden eine steife Schicht aus differenzierten Hautzellen, die Keratinperle. Indem sie auf die Spitze des Karzinoms drückt, hilft die Perle dem Tumor, durch die fragile Basalmembran zu brechen wie eine Faust durch Glas.
Wie sind Kräfte und Gene miteinander verbunden?
Vor dieser Arbeit seien Forscher davon ausgegangen, dass differenzierte Hautzellen, also solche mit fester Identität, keine mechanischen Kräfte erzeugen können, sagt Fuchs. »Das ist die Hauptüberraschung.« Als Nächstes wollen Fuchs und Fiore untersuchen, wie die Zellen solche mechanischen Kräfte wahrnehmen und wie sie die Kraft in ein Programm der Genexpression umwandeln, das möglicherweise mehr Basalmembran produziert oder die Differenzierung fördert.
Die Frage – wie Kräfte und Gene miteinander verbunden sind – sei entscheidend, sagt Alan Rodrigues, Entwicklungsbiologe an der Rockefeller University. Und das ist nicht nur ein Thema für Hautkrebs. »Die eigentlich zu Grunde liegende Frage ist, wie die Mechanik und die Moleküle denn zusammenhängen«, sagt er. Auch andere erforschen diesen Zusammenhang. »Es geht nicht nur um ›Gene machen alles‹ oder ›Mechanik macht alles‹«, sagt Lecuit. »Es wird ein interessanter Zweiklang zwischen den beiden sein.«

Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.