Sinne: Mit Gentherapie gegen Hörschäden
Angespannt beobachtet die junge Frau die Mimik und Gestik ihres Gegenübers und nickt oder lächelt, wenn sie glaubt, es könnte passen. Denn obwohl die Lautstärke ihres Hörgeräts erst kürzlich erhöht wurde, versteht sie in Unterhaltungen kaum noch etwas.
Hannah Corderman leidet an einer angeborenen Erkrankung namens Usher-Syndrom, die ihr langsam, aber sicher zwei Hauptsinne raubt. Auf Grund einer genetischen Mutation stellen Zellen ihres Innenohrs sowie ihrer Netzhaut bestimmte Proteine nicht mehr in ausreichender Menge her, die für eine normale Zellfunktion erforderlich sind. Deshalb hat sich, zusätzlich zum Verlust des Gehörs, auch ihre Sehkraft verschlechtert. Bereits als Teenager musste sie Nachtfahrten unterlassen. Heute, mit Mitte 20, erschweren ihr blinde Flecken selbst tagsüber das Sehen. Die Ärzte haben bei ihr das Usher-Syndrom Typ 2A diagnostiziert, eine erbliche Hör- und Sehbeeinträchtigung, die sich über Jahre hinweg allmählich ausprägt. Derzeit kann keine Therapie den Fortschritt der Erkrankung stoppen oder wenigstens verlangsamen. Die junge Frau lebt also mit dem Wissen, dass sie in 10 Jahren – vielleicht auch erst in 20, falls sich die Krankheit langsam entwickelt – taub und blind sein wird.
Es gibt nicht viel, was die Ärzte tun können, um ihr zu helfen. Sie könnten Corderman eines Tages ein Cochlea-Implantat einsetzen, das den Hörnerv direkt stimuliert, gewissermaßen unter Umgehung der Haarsinneszellen im Innenohr. Das würde auch dann noch eine gewisse Tonwahrnehmung ermöglichen, wenn die besten Hörgeräte hierfür nicht mehr ausreichen. Dem Funktionsverlust der Netzhaut wiederum ließe sich mit Retina-Implantaten entgegenwirken, welche die lichtempfindlichen Zellen elektrisch stimulieren. Doch werden sie selten eingesetzt, da sie dem tatsächlichen Sehempfinden nicht wirklich nahekommen.
Obwohl Corderman keine emsige Leserin wissenschaftlicher Zeitschriften ist, weiß sie, dass unweit ihres Wohnorts in einigen Bostoner Laboren mehrere hundert Mäuse gehalten werden, die eine ähnliche Hörstörung haben wie sie. Doch den Nagern geht es, im Gegensatz zu ihr, zunehmend besser. Denn Biologen haben mittels Gentherapie zusätzliche Erbanlagen in die Tiere eingeschleust, welche die korrekte Bauanleitung für jene Proteine tragen, an denen es erkrankten Individuen mangelt. 2017 berichteten die Biologin Gwenaëlle Géléoc vom Boston Children’s Hospital und ihre Kollegen von einer »beispiellosen Genesung« solcher Mäuse, denen die Wissenschaftler entsprechende DNA-Stücke ins Innenohr gespritzt hatten. Die Behandlung stellte das Hörvermögen der Tiere nahezu vollständig wieder her. Etwa zeitgleich teilte ein Forscherteam von der Harvard Medical School mit, es habe eine ähnliche Gentherapie getestet, allerdings an Mäusen mit einem anderen angeborenen Gendefekt – und zunächst eine leichte Verbesserung des Hörvermögens erzielt. Eine dritte im Bostoner Raum arbeitende Gruppe nutzte kürzlich Methoden des Genome Editing, um ein mutiertes Gen in »Beethoven-Mäusen« auszuschalten (die Tiere sind nach dem Komponisten benannt, der in seinen späteren Jahren ertaubte). All diese Fortschritte geben Anlass zu der Hoffnung, dass genetisch bedingte Hörstörungen – in den USA mit die häufigsten angeborenen Komplikationen – erstmals ursächlich behandelt werden können.
Dabei hat die Gentherapie einige schwierige Jahre hinter sich. 1999 verstarb auf Grund eines tragischen Behandlungsfehlers ein 18-jähriger Patient namens Jesse Gelsinger, der an einem angeborenen Enzymdefekt litt. Wissenschaftler der University of Pennsylvania hatten ihm in einem frühen Versuch, die Gentherapie anzuwenden, Adenoviren mit therapeutischen Genen injiziert. Allerdings waren die Partikel viel zu hoch dosiert. Kurz nach dem Eingriff verschlechterte sich Gelsingers Zustand, die Reaktion seines Immunsystems geriet außer Kontrolle und richtete sich gegen den eigenen Organismus. Der Patient starb an einem Multiorganversagen. Diese Tragödie rückte die Gentherapie in ein sehr schlechtes Licht; Fördermittelgeber zogen ihre Unterstützung zurück, und viele Forscher gingen auf Abstand.
Manche jedoch setzten ihre gentherapeutischen Arbeiten im Stillen fort, wobei sie sich zunächst auf Zell- und Tierversuche konzentrierten – in der Hoffnung, Behandlungsansätze für solch komplexe Erkrankungen wie Osteoarthritis, Krebs oder auch Diabetes Typ 1 entwickeln zu können. Zur Sicherheit reduzierten sie die Dosis der als Genfähren dienenden Viren, um eine überschießende Reaktion des Immunsystems zu vermeiden. Zudem wendeten sie sich von dem Virustyp ab, der bei Gelsinger benutzt worden war, und experimentierten stattdessen mit anderen Arten infektiöser Partikel. Dabei zeichnete sich eine viel versprechende Alternative zu Adenoviren ab, nämlich so genannte Adeno-assoziierte Viren (AAV), die als Genfähren keine Immunkomplikationen auszulösen scheinen, da sie menschliche Zellen nicht schädigen. Zudem gelang es besser, die Wirkung der viralen Gentransporter auf bestimmte Zellen zu begrenzen. »Es geht darum, die richtigen Genfähren für die richtige Krankheit und die richtigen Zielzellen zu finden, sie richtig zu dosieren und zu verstehen, wo im Körper sie ihre Wirkung entfalten«, sagt Cynthia E. Dunbar, die an den National Institutes of Health (NIH) forscht und bis vor Kurzem Präsidentin der American Society of Gene & Cell Therapy war.
Das Interesse an Gentherapie wächst massiv
Die Bemühungen trugen Früchte: Die amerikanische Arzneimittelbehörde FDA hat die ersten Gentherapieverfahren für die Anwendung am Menschen zugelassen. Im August 2017 gab sie grünes Licht für Kymriah, ein gentechnisches Verfahren zur Behandlung der akuten lymphatischen Leukämie, und im selben Jahr genehmigte sie die erste Gentherapie für eine seltene Form angeborener Blindheit. Pharmaunternehmen und Risikokapitalgeber pumpen nun viel Geld in dieses Forschungsgebiet, wie Dunbar berichtet. An der Jahrestagung der American Society of Gene & Cell Therapy hätten 2018 etwa 3400 Personen teilgenommen; fünf Jahre zuvor waren es lediglich 1200 gewesen.
Das neu erweckte Interesse an der Gentherapie wendet sich auch der Behandlung von vererbten Hörstörungen zu. Viele meinen, zunehmende Taubheit habe vor allem mit dem Älterwerden oder mit Unfällen zu tun, doch gehören Hörschäden zu den häufigsten Geburtsdefekten beim Menschen; sie betreffen etwa 3 von 1000 Neugeborenen. Genveränderungen zeichnen für mehr als die Hälfte davon verantwortlich – einschließlich des Usher-Syndroms. Diese Krankheit bietet sich als Ziel für Gentherapien besonders an, da die Patienten Mutationen in einzelnen Genen tragen, deren funktionaler Ersatz die Krankheitsursache und damit auch die Symptome beheben sollte. Bestimmte Typen der Erkrankung – etwa jener, unter dem Corderman leidet – schreiten relativ langsam fort, was ein Zeitfenster nach der Diagnose eröffnet, in dem sich die genetisch bedingte Schädigung stoppen lässt. Der zunehmende Funktionsverlust betrifft unter anderem die Haarsinneszellen im Innenohr, die normalerweise von außen eintreffende Schallwellen in Nervensignale umwandeln, welche sie ans Gehirn weiterleiten. Bei Corderman und anderen vom Usher-Syndrom Betroffenen sorgen defekte Gene dafür, dass die Haarsinneszellen nicht mehr richtig funktionieren.
Jene Zellen gentherapeutisch zu behandeln, bietet die Chance, die Krankheit an der Wurzel zu bekämpfen, statt mit Hightech-Hörgeräten die Symptome zu lindern. Die jüngst in Tierversuchen erzielten Erfolge seien »sehr beeindruckende und viel versprechende erste Schritte«, wie Theodore Friedmann meint, ein Kinderarzt und Gentherapie-Forschungskoordinator an der University of California, San Diego, der an diesen Arbeiten nicht beteiligt war. Nun müsse das Verfahren aber noch erfolgreich auf den Menschen übertragen werden.
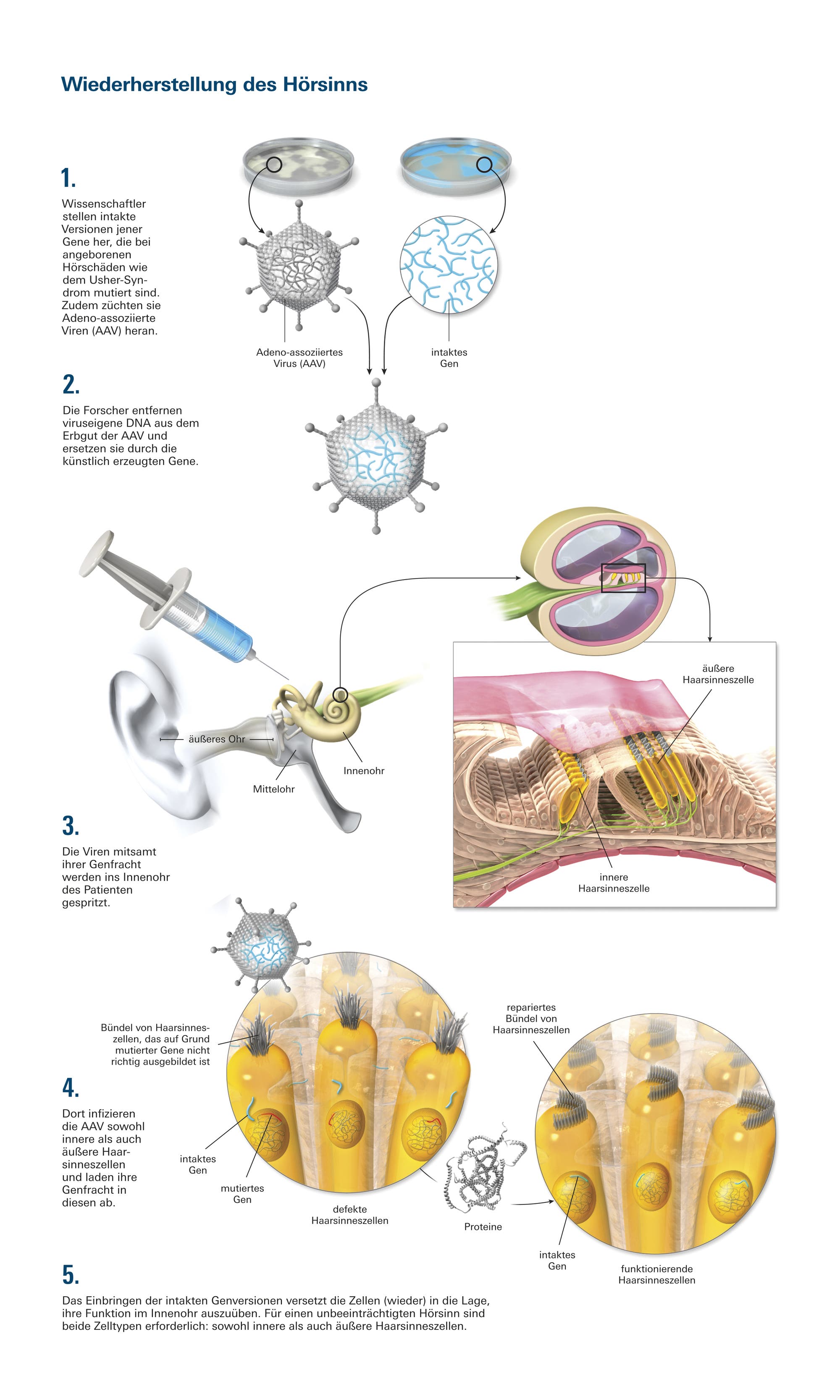
Wie ein solcher Tierversuch abläuft, konnte ich 2016 in einem Labor der Harvard University beobachten. Ich schaute dort Bence Gyorgy über die Schulter, der in der Abteilung für Neurobiologie mit Mäusen experimentierte, die mit schadhaften Haarsinneszellen gezüchtet wurden; ihre Gene wiesen ähnliche Defekte auf wie die von Usher-Syndrom-Patienten. Gyorgy beugte sich über ein solches Tier, das narkotisiert worden war, und machte einen winzigen Einschnitt hinter dessen Ohr. Von da aus schob er eine feine Kanüle durch verschiedene Gewebeschichten bis zu einem winzigen Bereich im Mittelohr, der als Rundfenstermembran bezeichnet wird und einen Zugang zum Innenohr ermöglicht. Dort hinein injizierte der Forscher eine blassrosa Lösung mit etwa 200 Milliarden AAV-Partikeln. Alle davon enthielten eine intakte Form jenes Gens, das in der Maus mutiert vorlag und ihren Hörschaden verursachte.
Der Eingriff führte dazu, dass die AAV die Haarsinneszellen im Innenohr infizierten und dabei ihre Genfracht in diese einschleusten. Wie die Wissenschaftler mittlerweile wissen, können sie nicht jeden AAV-Typ hierfür einsetzen. Manche Viren bringen ihre Genfracht nur in die inneren Haarsinneszellen ein, die mit Nervenzellen kommunizieren – aber nicht ausreichend in die äußeren Haarsinneszellen, die das einlaufende Schallsignal zunächst verstärken. Um das Hörvermögen möglichst vollständig wiederherzustellen, muss die Genfähre beide Zelltypen infizieren, betont der Neurobiologe David Corey von der Harvard University, ein Kollege Gyorgys, der ebenfalls entsprechende Versuche an Mäusen durchgeführt hat.
Mittels Versuch und Irrtum sowie gezielten Umstrukturierungen des viralen Genoms isolierten die Forscher einige AAV-Typen, die beide Haarsinneszellsorten im Innenohr als Ziel erkennen. Die Wissenschaftler veränderten bestimmte Proteine der äußeren Virushülle und erhielten so Moleküle, die an die Oberfläche beider Zelltypen andocken und dem Virus somit das Eindringen in sie ermöglichen. Gwenaëlle Géléoc und ihre Mitarbeiter berichteten 2017 in einem Fachartikel, ein entsprechend modifizierter AAV-Typ in Mäusen mit angeborener Taubheit habe funktionstüchtige Haarsinneszellen hervorgebracht. Andere Forschergruppen teilten mit, sie hätten AAV in die inneren Haarsinneszellen von älteren Labormäusen eingebracht, deren Ohren mehr denen von kleinen Kindern ähneln.
Verdächtige Gene
Das war aber nur eine Teilstrecke auf dem Weg dahin, Hörschäden erfolgreich zu behandeln. Hinzukommen musste noch, jene Mutationen zu finden, die zur Ausprägung defekter Haarsinneszellen führen. Schon in den 1990er Jahren hatten Wissenschaftler damit begonnen, indem sie Familien identifizierten, in denen die typischen Hör- und Sehstörungen des Usher-Syndroms auftraten, und deren Genome miteinander verglichen. Dabei fielen mehrere Gene auf, die an der Entwicklung sowohl der Ohren als auch der Augen beteiligt zu sein schienen und als mögliche Orte krank machender Mutationen besonders verdächtig waren. Forscher züchteten daraufhin Mäuse mit oder ohne Mutationen in den entsprechenden Erbanlagen und beobachteten, welche Tiere die Krankheitssymptome aufwiesen. Es zeigte sich, dass Modifikationen des Gens USH2A hinter dem allmählich fortschreitenden Erkrankungstyp stecken, an dem Corderman leidet; die nichtmutierte Version dieser Erbanlage bringt gesunde Haarsinneszellen hervor. An dem schwersten und sich am schnellsten ausprägenden Usher-Syndrom vom Typ 1 sind Mutationen in fünf verschiedenen Genen beteiligt, darunter der Erbanlage USH1C, die für das Protein Harmonin codiert.
In den zurückliegenden Jahren hat das Team um Gwenaëlle Géléoc all diese Puzzleteile zusammengefügt. Sie und ihr Ehemann, der HNO-Arzt Jeffrey Holt, produzierten zusammen mit weiteren Forschern eine AAV-Variante mit maßgeschneiderter Virushülle. Sie entfernten mehrere Erbanlagen aus dem Genom des Virus, die mit seinem Fortpflanzungszyklus zu tun haben, und ersetzten sie durch intakte Versionen des Gens USH1C. Zudem führten sie einen so genannten Promotor ein – eine DNA-Sequenz, die dafür sorgt, dass USH1C in den Haarsinneszellen abgelesen wird. Als die Forscher das Genkonstrukt mit Hilfe des Virus in die Zellen einschleusten, produzierten diese in großer Menge intakte Harmoninmoleküle, so dass sie ihre normalen Zellfunktionen wieder ausüben konnten. Die Haarsinneszellen stellten zwar weiterhin auch defekte Harmoninvarianten her, da ihr Genom ja nach wie vor das mutierte USH1C enthielt, dies schadete aber nicht.
Auf Basis dieser Methode haben die Forscher am Boston Children’s Hospital dann Mäuse behandelt, die unter Hörschäden litten ähnlich jenen Menschen mit Usher-Syndrom. Sie brachten die modifizierten Viren mit einem chirurgischen Eingriff, wie ich ihn bei Gyorgy beobachtet hatte, in die Tiere ein. In den ersten beiden Wochen infizierten die Viren nur einige wenige Haarsinneszellen im Innenohr der Nager; doch nach sechs Wochen hatten sie rund 80 Prozent von diesen befallen. Das Wichtigste jedoch war, dass die so behandelten Mäuse wieder auf Geräusche reagierten. Wurden sie einem plötzlichen Alarmton ausgesetzt, flüchteten viele, die es zuvor nicht getan hatten – die einst tauben Nager konnten wieder hören. Haarsinneszellen üben freilich noch eine weitere wichtige Funktion im Körper aus: Sie reagieren auf Drehbewegungen sowie auf horizontale oder vertikale Beschleunigungen des Körpers und wirken entscheidend am Gleichgewichts- und Orientierungssinn mit. Mäuse mit geschädigten Haarsinneszellen, wie sie bei verschiedenen Formen des Usher-Syndroms auftreten, zeigen oft Bewegungsstörungen und tun sich schwer damit, ihre Position im Raum zu erkennen. Statt im Käfig herumzuschnüffeln, kauern sie sich in eine Ecke. Und im Gegensatz zu ihren gesunden Artgenossen, die geborene Schwimmer sind, paddeln sie im Wasser panisch umher und versuchen festzustellen, wo »oben« ist. (Die Forscher nehmen die Tiere rechtzeitig heraus, bevor diese unter zu großen Stress geraten.) Wenn die Gentherapie tatsächlich die Funktion der Haarsinneszellen wiederherstellt, sollten damit auch jene Symptome verschwinden.
Als ich direkt nach meinem Besuch an der Harvard University das Labor von Géléoc und Holt aufsuchte, sah ich mit Gentherapie behandelte Mäuse, die sich erstaunlich normal verhielten. Tiere, die dem Eingriff zwei Monate zuvor unterzogen worden waren, legten im Wasser praktisch dasselbe Verhalten an den Tag wie ihre gesunden Artgenossen und standen diesen selbst hinsichtlich des Orientierungssinns in nichts nach. Es war verblüffend, wie wenig sich die beiden Gruppen voneinander unterschieden.
Trotz all dieser Erfolge bleiben noch große Schwierigkeiten zu lösen, bis es möglich sein wird, auch menschliche Usher-Syndrom-Patienten mit maßgeschneiderten AAV zu behandeln. Eines der Probleme lautet, dass die derzeit verwendeten Viren zu klein sind. Ihre Größe genügt zwar, um Gene zur Korrektur des Usher-Syndroms Typ 1C einzubringen; an dieser Variante litten die Mäuse, die in den Studien so gut auf die Gentherapie ansprachen. Aber bei vielen anderen Untertypen des Usher-Syndroms wirken weit größere Gene am Krankheitsgeschehen mit. An Cordermans Erkrankungsform beispielsweise ist eine Erbanlage beteiligt, für die in dem kleinen Genom der AAV schlicht zu wenig Platz ist.
Zerlegt und wieder zusammengefügt
Eine mögliche Lösung wäre, umfangreiche Gene in mehrere Stücke zu zerschneiden, die dann mittels verschiedener Genfähren verabreicht würden. Jedes dieser Stücke müsste Enden aufweisen, die sich ganz spezifisch nur mit bestimmten anderen Enden zusammenlagern, so dass die verschiedenen Genfragmente am Zielort zum gewünschten Konstrukt zusammenkämen. Die defekte Erbanlage bei Cordermans Usher-Typ etwa ist so lang, dass sie in drei Teile zerschnitten werden müsste. Damit die Gentherapie zum Erfolg führt, müssten die drei viralen Genfähren mit jeweils einem dieser Abschnitte allesamt in die Haarsinneszellen des Innenohrs gelangen und ihre Fracht darin abladen, so dass die Genfragmente dort zueinanderfinden und sich korrekt verbinden. Die hochspezifische Paarung der Nukleinbasen ermöglicht dies zwar – normalerweise lagern sich nur DNA-Stränge mit komplementärer Basensequenz zusammen –, doch die Methode ist kompliziert und damit störanfällig.
Eine weitere Option lautet, größere Viren zu verwenden, die nicht zu den AAV gehören, und diese so zu verändern, dass sie keine umfassende Immunreaktion provozieren. Man könnte auch komplett auf Viren verzichten und stattdessen versuchen, das Genmaterial mit Hilfe von Nanopartikeln einzubringen, also mit winzigen künstlichen Körnchen, die Zellmembranen durchdringen können. Mehrere Forscher, darunter Géléoc und Holt, untersuchen zudem, ob sich das schadhafte Gen mittels der Genome-Editing-Methode CRISPR-Cas entfernen und durch eine korrigierte Version seiner selbst ersetzen lässt. Das Usher-Syndrom ist eine rezessiv vererbte Erkrankung, die sich nur dann ausprägt, wenn beide Kopien des Gens (die von der Mutter und die vom Vater geerbte) defekt sind. Falls es gelingt, eine davon herauszuschneiden und gegen eine intakte auszutauschen, sollte das den weiteren Fortschritt der Erkrankung verhindern.
Bislang ist das leider noch niemandem geglückt; die CRISPR-Cas-Technik scheint sich eher zum Herausschneiden von DNA-Abschnitten als zu ihrem Einbau zu eignen. Aus diesem Grund beschränkt sich die Anwendung des Genome-Editing-Verfahrens derzeit auf Mäuse mit einer seltenen Form des Hörschadens, bei dem lediglich eine Genkopie defekt ist statt beider. Wenn die problematische Kopie ausgeschaltet wird, kann die verbleibende gesunde ihre Arbeit fortsetzen und für eine korrekte Zellfunktion sorgen – ein Ansatz, der bei den Beethoven-Mäusen gut funktioniert. Allerdings ist mittlerweile bekannt, dass CRISPR-Cas unerwünschte DNA-Veränderungen herbeiführen kann. Momentan hält so gut wie niemand die Methode für ausgereift genug, um am Menschen eingesetzt zu werden. Noch scheint es in der Gentherapie keine wirkliche Alternative zu viralen Fähren zu geben.
Doch egal, welches Vehikel die therapeutischen Gene am Ende in den Organismus transportiert: Es wird wenig helfen, solange sich die Diagnose erblicher Hörschäden bei Kleinkindern nicht deutlich verbessert – denn die Betroffenen profitieren am meisten von frühen Interventionen. In den USA werden zwar die meisten Neugeborenen auf ihre Hörfunktion hin untersucht, aber die Ärzte stellen dabei selten eine spezifische Erkrankung fest, geschweige denn deren genetische Ursache. Das trifft auch auf Corderman zu: Erst in ihrer Highschool-Zeit kam heraus, an welcher Erbkrankheit sie leidet. Das muss sich ändern, damit die betroffenen Kinder rechtzeitig behandelt werden können.
TEIL 1 – AUSGABE 7/2019: VERERBTEN HÖRVERLUST VERHINDERN Neu entwickelte Genfähren ermöglichen einen Durchbruch bei der Therapieentwicklung.
BESSERE VERPACKUNG FÜR GENPAKETE Künstlich veränderte Viren sollen helfen, Genmaterial in bestimmte Körperzellen einzuschleusen, um so Erbkrankheiten zu behandeln.
TEIL 2 – AUSGABE 8/2019: SCHÖNE NEUE HAUT Eine Erfolgsstory: Drei Jahre nach dem Eingriff geht es einem Kind mit gentechnisch hergestellter Ersatzhaut blendend.
TEIL 3 – AUSGABE 9/2019: GENTHERAPIE IM MUTTERLEIB Ein neuer Ansatz sorgt für Diskussion: Kann man Gendefekte bereits vor der Geburt reparieren? Und wenn ja, soll man das überhaupt?
Hannah Corderman wartet nicht darauf, dass das rasant wachsende Interesse an der Gentherapie in Form von Behandlungsverfahren bei ihr ankommt. Sie hat ihre Ausbildung abgeschlossen, arbeitet in der Marketing-Abteilung des Bauunternehmens ihrer Familie und ist entschlossen, ihr Leben in vollen Zügen zu genießen, solange dies noch möglich ist. So hat sie mehrere Reisen zu den Polarlichtern gebucht: »Seit mir bewusst ist, dass ich nicht mehr sehr viel Zeit hierfür habe, hat sich meine Einstellung zum Leben komplett verändert.« Corderman engagiert sich für andere Patienten und ermutigt diese dazu, ihr Leben in die Hand zu nehmen und sich von der Krankheit nicht ausbremsen zu lassen. Der Verlust des Gehörs bedeutet für sie nicht, sich in die Stille zurückzuziehen.




Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.