Lexikon der Biologie: Raster-Kraftmikroskop
Raster-Kraftmikroskops, Atomic-Force-Microscope, Scanning-Force-Microscope, Abk. AFM bzw. SFM, höchstauflösendes Rastersondenmikroskop (Rastersondenmikroskopie), dessen Einsatzbereich im Gegensatz zum Raster-Tunnelelektronenmikroskop nicht auf leitende Untersuchungsobjekte begrenzt ist. Das AFM basiert auf der Messung von Kräften zwischen einer Meßspitze (Sonde) und der zu untersuchenden Probe. Die zwischen Spitze und Probe auftretende Kraft resultiert aus verschiedenen physikalischen Wechselwirkungen. Diese auf atomarer Ebene sehr weitreichenden Kräfte (>100 nm) sind die Ursache vieler makroskopischer Erscheinungen (z.B. Adhäsion, Oberflächenspannung [Kapillarität], Sekundärstrukturen und Tertiärstrukturen von Makromolekülen). Wesentliche anziehende Wechselwirkungen sind die zwischen Dipolen auftretenden van-der-Waals-Kräfte. Repulsive (abstoßende) Kräfte entstehen, wenn die Spitze im Abstand weniger Nanometer (10–9 m) über die Probenoberfläche bewegt wird und es zu einer Überlappung der Elektronenaufenthaltsbereiche (Orbital [Abb.]) sich annähender Atome von Spitze und Probe kommt. Aufgrund des sog. Pauli-Prinzips (2 Elektronen können sich nicht in identischen Quantenzuständen befinden) führt dies zu starken Abstoßungskräften. Beide Wechselwirkungen, anziehende Dipolwechselwirkung und abstoßende Pauli-Kräfte, würden eine frei bewegliche Spitze in einem Gleichgewichtsabstand halten. Die AFM-Spitze besteht meist aus einer Silicium- bzw. Siliciumnitrid (Si3N4)-Pyramide, die sich an einem ca. 100-200 μm langen Ausleger (Kantilever; vgl. Abb. 1 ) aus Siliciumoxid befindet. Zur Messung der Kantilever-Auslenkung mit einer Auflösung von 0,1 nm wird ein Laserstrahl (Laser) auf die vergoldete Oberseite des Kantilevers gelenkt und der reflektierte Laserstrahl auf einen Photodetektor geleitet ( vgl. Abb. 1 ). Die zwischen Sondenspitze und Probenoberfläche wirkenden Kräfte verbiegen den Kantilever und verändern so die Intensität des reflektierten Laserstrahls am Ort des Photodetektors. Wird die Probe mit einem sog. Piezoaktuator in Rasterschritten von wenigen Ångström (1 Å = 0,1 nm) lateral unter der Sonde verschoben (xy-Koordinaten), kann die jedem Rasterpunkt zugeordnete Kantileverauslenkung (z-Koordinate) bzw. die dabei wirkende Kraft bestimmt und in ein dreidimensionales Bild der Oberfläche umgesetzt werden. Die Abbildung der Probenoberfläche mit dem AFM kann auf 2 grundsätzlich verschiedene Arten erfolgen. Bei der gebräuchlichsten, der Contact-Force-Mode-Methode, befindet sich die Spitze so nahe an der Probenoberfläche, daß immer im abstoßenden Bereich der Wechselwirkungskräfte gearbeitet wird. Die auftretende Kraft (10–100 pN; pN = Piconewton = 10–12 Newton) wird über die Auslenkung des Kantilevers gemessen. Bei einem alternativen Verfahren, der Non-Contact- oder Attractiv-Mode- bzw. Tapping-Mode-Methode, befindet sich die Spitze so weit von der Oberfläche entfernt, daß der anziehende Anteil der Wechselwirkung dominiert. Die Wechselwirkungskraft wird dabei über die Resonanzfrequenzänderung des vertikal schwingenden (tapping) Kantilevers bestimmt. – Die AFM/SFM-Mikroskopie hat sich in den Biowissenschaften zu einem wichtigen Werkzeug der Strukturbiologie und Biophysik entwickelt, die sich als Methode zur Oberflächendarstellung, insbesondere für Untersuchungen an zweidimensionalen Proteinkristallen (z.B. Proteinkristall-Monolayer; Proteinkristallisation) oder Membranen bzw. Membranproteinen eignet. Hierzu werden die Proben auf Glas, Glimmer oder Goldoberflächen immobilisiert und unter Umgebungsbedingungen oder, um nativen Bedingungen möglichst nahe zu kommen, in wäßrigen Pufferlösungen meist mit der tapping-mode-Methode gescannt. Mit diesem Verfahren gelang es z.B., Konformationsänderungen bei Membranproteinen (OmpF) und DNA-Strukturen (Bildung kreuzförmiger DNA) zu beobachten. Zukunftsweisend könnte der jüngste Einsatz der AFM-Mikroskopie bei der Messung von Proteinfaltungskräften (Proteine) sein. Ein weiteres Beispiel moderner Entwicklungen ist die Immunokraftmikroskopie, bei der Antikörper auf die Spitze eines AFM aufgebracht werden und ihre Wechselwirkungskräfte mit einer Oberfläche erfaßt werden. Einen interessanten Einsatz findet das AFM ferner für Strukturierungsanwendungen ( vgl. Abb. 2/4 ), bei denen die Spitze entweder lediglich als mechanisches Verschiebe-Werkzeug wirkt oder durch Anlegen geeigneter Felder örtlich (elektrochemisch oder thermisch) zu Materialanlagerung oder -abtrag führt. Kernspinresonanzmikroskopie, Nanotechnologie.
Raster-Kraftmikroskop
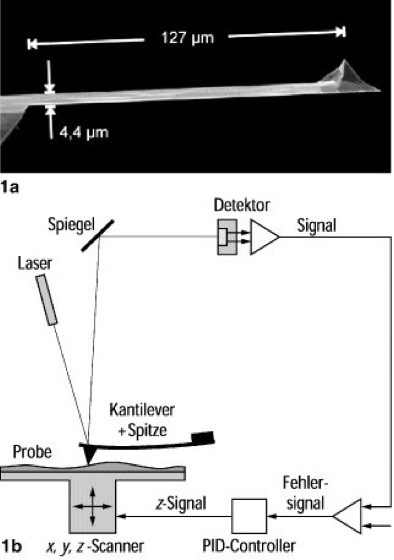
Abb. 1:
1a Elektronenmikroskopische Aufnahme eines AFM-Kantilever-Sensors. Der lange, freitragende Balken wirkt als Blattfeder mit niedriger Federkonstante. 1b Übliches Aufbauschema eines AFMs mit Lichtzeigerdetektion. Die Schwingung des Kantilevers wird durch die Bewegung des Laserreflexes auf dem Detektor erfaßt.

Raster-Kraftmikroskop
Abb. 2:
2 Tastkopf eines kommerziellen, hochintegrierten AFMs, das ohne Schwingungsisolierung auf die untersuchende Oberfläche aufgelegt werden kann. Die Grobjustierung des Arbeitsabstands erfolgt über die 3 Schrauben am Rand. 3 Kraftmikroskopie mit Abstandsdetektion durch einen Tunnelsensor. 4 Mechanische Strukturierung von Oberflächen mit einer AFM-Spitze („Nanoindenting“). 5 Aufnahme von auf einer Nickeloberfläche mit Hilfe des AFM gezielt zu einer Buchstabenfolge (IBM) verschobenen Xenonatomen. 6 Durch Nanoindenting in eine Polymerschicht mit Makroporen geschriebenes Logo der Universität Münster.








Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.