Lexikon der Physik: NMR-Spektroskopie
NMR-Spektroskopie, Anwendung der kernmagnetischen Resonanz zur Analyse der chemischen Struktur von Molekülen. Wichtigste Meßgrößen sind zunächst die chemische Verschiebung und die Kopplung, bei komplexeren Verfahren zusätzlich Austausch- und Polarisationstransfer-Phänomene. Besonders gute Auflösungen erzielt man in der NMR-Spektroskopie unter den Bedingungen des sog. motional narrowing, wie sie in leichtbeweglichen Flüssigkeiten herrschen. In Festkörpern und hochviskosen Substanzen sind die Spin-Spin-Relaxationszeiten dagegen kürzer, so daß eine hohe spektrale Auflösung nur mit speziellen Verfahren wie z.B. MAS erzielt werden kann.
Zusammenhang zwischen Spektrum und Molekülstruktur:
Besonders wichtig ist die chemische Verschiebung, die für bestimmte chemische Gruppen weitgehend unabhängig von der Struktur des restlichen Moleküls jeweils in spezifischen Bereichen liegt (siehe Abb. 1). Daraus kann bereits eine Grobinformation über den Aufbau des Moleküls abgeleitet werden. Zusätzliche Informationen liefert die Kopplung: Aus ihr kann entnommen werden, mit welchen benachbarten Gruppen die Kerne mit einer bestimmten chemischen Verschiebung in Wechselwirkung stehen (siehe Abb. 2).
Während bei kleinen, einfachen Molekülen bereits ein einfaches Protonenspektrum eindeutige Informationen über die chemische Struktur liefert, ergeben sich bei größeren Molekülen extrem unübersichtliche Spektren, die allein nur schlecht zur Ableitung von chemischen Strukturinformationen geeignet sind. In solchen Fällen können zusätzliche Strukturinformationen gewonnen werden durch
- Spektren von Heterokernen (z.B. 13C, 19F), die sich durch wesentlich größere chemische Verschiebungen auszeichnen, aber oft nur in kleinen Mengen in den zu analysierenden Substanzen enthalten sind),
- Doppelresonanzexperimente,
- ›mehrdimensionale‹ NMR-Spektren.
Doppelresonanzexperimente:
Doppelresonanz wird in der NMR-Spektroskopie für verschiedene Zwecke eingesetzt:
1) Zur Entkopplung der Resonanzen von benachbarten Kernen (z.B. Protonenentkopplung) während der Aufnahme eines 13C-Spektrums. Durch die Entkopplung erhält man deutlich vereinfachte Spektren, in denen außerdem die Intensität der verbliebenen Linien deutlich gesteigert werden kann. Zur Entkopplung wird das koppelnde Kernsystem mit hoher Intensität und Bandbreite resonant angeregt, so daß sich infolge der schnellen Übergänge die Kopplung mit den anderen Kernen vollständig aus dem Spektrum herausmittelt. 2) Zur Steigerung der Nachweisempfindlichkeit von Kernen mit geringem magnetischem Moment (z.B.13C): Durch Polarisationstransfer-Verfahren kann diesen der höhere Polarisationsgrad von Kernen mit größerem Moment aufgeprägt werden (z.B. Protonen), so daß eine höhere Signalintensität erreicht wird. Diese kann zusätzlich gesteigert werden, wenn auch die Detektion der Resonanzsignale nach einem Rücktransfer der Polarisation auf die empfindlicheren Kerne erfolgt. Derartige Kreuzpolarisations-Experimente finden vor allem bei der Untersuchung von Festkörpern und bei biologischen Systemen Anwendung. 3) Zur Selektion oder Kennzeichnung von Kernen mit bestimmten Bindungspartnern. Dies ist z.B. bei den heteronuklearen Verfahren in der mehrdimensionalen NMR der Fall.
Mehrdimensionale NMR:
Mehrdimensionale NMR-Spektren können in der Puls-NMR durch Pulsfolgen erzeugt werden, bei denen zwischen die Anregung und die Aufnahme des freien Induktionszerfalls (FID) eine Evolutionzeit te eingeschoben ist, die zwischen den einzelnen Anregungsvorgängen systematisch variiert wird. Zur Auswertung der Spektren wird dann sowohl über die Aufnahmezeit als auch über die Evolutionszeit jeweils eine Fourier-Transformation ausgeführt.
Zweidimensionale NMR-Experimente können sowohl homonuklear als auch heteronuklear durchgeführt werden und liefern je nach gewählter Puls-Sequenz unterschiedliche Informationen über Parameter wie homonukleare oder heteronukleare J-Kopplungen, (chemische) Austausch- und Polarisationstransfer-Vorgänge (z.B. NOESY).
Durch Einfügen weiterer variabler Evolutionszeitintervalle und weiterer Hochfrequenzkanäle können NMR-Spektren höherer Dimension erzeugt werden. Solche Methoden werden beispielsweise bei der Strukturanalyse von biologischen Makromolekülen wie Proteinen eingesetzt, wo mittlerweile die Aufnahme von bis zu vierdimensionalen Spektren üblich ist.
Die Aussagekraft von mehrdimensionalen NMR-Spektren kann in einigen Fällen zusätzlich gesteigert werden durch die Einführung von festen Wartezeiten (sog. Mischungszeiten) an bestimmten Stellen der Sequenz ,durch die beispielsweise eine Selektion von Signalen mit bestimmten Kopplungskonstanten möglich ist.
NMR-Spektroskopie an kristallinen und amorphen Festkörpern:
Im Gegensatz zu den Flüssigkeiten ist in Festkörpern die Bedingung des motional narrowing nicht gegeben. Vielmehr kommt es durch den Einfluß der dipolaren Kopplung zu einer starken Verbreiterung der Spektrallinien. Dies begründete die Entwicklung spezieller Pulsfolgen und NMR-Spektrometer. Aus NMR-Sicht liegt der physikalisch wesentliche Unterschied zwischen Flüssigkeiten und Festkörpern in der raschen Zufallsbewegung, die die Kerne und damit die Kernspins in einer Flüssigkeit ausführen, während sie in Festkörpern wesentlich lokalisierter und – soweit die Vektoreigenschaften betroffen sind – richtungsbezogener sind.
Die wesentlich größeren NMR-Linienbreiten in Festkörpern führen dazu, daß in vielen Fällen nicht der FID, sondern das Spinecho untersucht wird, denn der mit der größeren Linienbreite verbundene schnellere Abfall des FID-Signals in der Zeitdomäne macht eine Beobachtung schwierig, in vielen Fällen unmöglich.
NQR, sowie der Einfluß der Quadrupolwechselwirkung auf den Zentralübergang ( ![]()
), geben Aufschluß über lokale Strukturen des Festkörpers, wie sie mit anderen Standardmethoden der Strukturbestimmung wie Röntgenstreuung oder Neutronenstreuung oft nicht aufgelöst werden können. Das gilt insbesondere auch für amorphe Festkörper wie Gläser.
Die Mechanismen der Linienverbreiterung in Festkörpern sind die direkte Dipol-Dipol-Kopplung, die Anisotropie der chemischen Verschiebung, die durch die eingeschränkten Bewegungsmöglichkeiten der Atome und Moleküle im festen Zustand hervorgerufen werden, sowie die Quadrupolkopplung für Atomkerne mit Kernspin I > 1 / 2.
Techniken, um die Linienbreite zu verringern und die Beobachtung der Hyperfeinstruktur zu ermöglichen, sind heteronukleares und homonukleares Entkopplung sowie MAS.
Aktuelle Entwicklungen und Trends:
Der klassische Anwendungsbereich der NMR-Spektroskopie ist nach wie vor die chemische Strukturaufklärung, die v.a. im Zusammenhang mit der Analyse von Proteinen und anderen biologischen Substanzen von großer Bedeutung ist. Hier ist in den vergangenen Jahren eine Tendenz zu immer höheren Magnetfeldern erkennbar gewesen, die einerseits zu einem verbesserten Signal-Rausch-Verhältnis führen und andererseits eine besonders hohe Auflösung der chemischen Verschiebung zulassen. Die höchsten Frequenzen, mit denen kommerzielle NMR-Spektrometer zur Zeit verfügbar sind, liegen bei 900 MHz (entsprechend einem Magnetfeld von 21 T). Eine weitere Steigerung der Arbeitsfrequenzen von NMR-Spektrometern wird zur Zeit v.a. dadurch erschwert, daß bereits für die Erzeugung von 21 T-Feldern bei der Temperatur des flüssigen 4He keine Supraleiter verfügbar sind, so daß die Temperatur des Heliums durch ständiges Abpumpen verringert werden muß. Solche Spektrometer werden deshalb mit einem integrierten geschlossenen Heliumkreislauf für den Magneten ausgestattet.
Andere Entwicklungslinien der NMR-Spektroskopie sind die direkte Verknüpfung mit chemischen Trennungsmethoden wie der Flüssigkeitschromatographie und Ansätze zur Steigerung der Nachweisempfindlichkeit bei kleinen Probenmengen (z.B. durch Mikrospulen).
Im Zusammenhang mit der Entwicklung von Spektroskopie-Methoden immer höherer Komplexität und Dimensionalität stellen neuartige Ansätze zur Reduktion des Meßzeitbedarfs und zur automatisierten Auswertung von Spektren eine immer wichtigere Herausforderung dar.
In der klinischen Forschung gewinnt in-vivo NMR-Spektroskopie zunehmend an Bedeutung. Bei diesen Anwendungen werden entweder Spektren von ganzen Organismen oder aber aus durch eine entsprechende Präparation der Magnetisierung selektierten Volumenelementen (z.B. VOSY) aufgenommen.
Man erhofft sich, frühzeitig krankhafte Veränderungen in einem gegenüber gesunden Menschen veränderten Spektrum zu erkennen und die Biochemie der Erkrankung genauer untersuchen zu können. Hauptuntersuchungsgebiet ist hierbei das menschliche Gehirn. Der wegen seiner Häufigkeit am besten untersuchte Kern ist Wasserstoff (1H), mit den dabei am häufigsten auftretenden Verbindungen von NAA, Creatin, Cholin, Creatin Phosphat und Lactat. Aber auch Phosphor (31P) ist wegen der am Energiestoffwechsel beteiligten Komponenten (ATP, Creatin-Phosphat) von großem Interesse.
In der Biophysik hat die NMR-Spektroskopie zentrale Bedeutung bei der Bestimmung der Struktur von Biomakromolekülen in wäßrigen Lösungen als Alternative zur Kristallstrukturanalyse. Aus den NMR-Signalen werden obere Schranken von Atom-Atom-Abständen gewonnen, welche zusammen mit stereochemischen Zusatzinformationen zur Generierung von Strukturmodellen benutzt werden. Auch die Hydration von Biomakromolekülen bzw. das Verhalten paramagnetischer Sonden (z.B. Mn2+) in biologischen Systemen kann mit NMR-Spektroskopie untersucht werden.

NMR-Spektroskopie 1: Typische chemische Verschiebungen für die Protonenresonanzen bestimmter funktioneller Gruppen. Die Verschiebungen δ sind in ppm Abweichung von der Resonanz in Tetramethylsilan (TMS) angegeben.
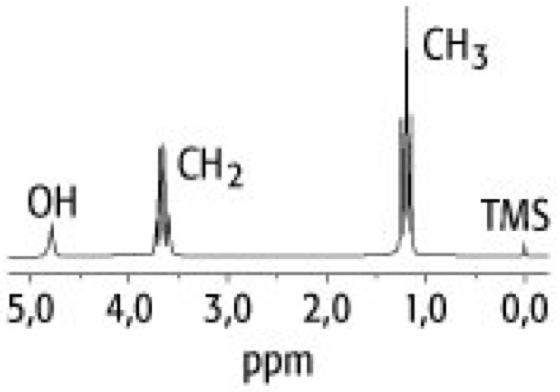
NMR-Spektroskopie 2: Protonen-NMR-Spektrum von Ethylalkohol. Deutlich erkennbar sind die Aufspaltungen der Linie für die CH3-Gruppe in drei Linien infolge der Kopplung mit den beiden Protonen in der CH2-Gruppe sowie die Aufspaltung der Linie der CH2-Gruppe in vier Linien durch Kopplung mit den drei Protonen in der CH3-Gruppe. Die Kopplung der CH2-Gruppe mit dem OH-Proton kann nicht aufgelöst werden.

NMR-Spektroskopie 3:13C-Festkörper-NMR-Linienverschmälerungstechniken; a) einfache Resonanz; b) mit dipolarem Entkoppeln – die überlagernden Linien im unteren Bildteil stellen einen Fit aus den Spektren von 5 Gitterplätzen dar; c) mit dipolarem Entkoppeln und Magic Angle Spinning (MAS).
Literatur:
Canet, D., NMR-Konzepte und Methoden, Springer, Heidelberg, 1994.
Friebolin, H., Ein- und zweidimensionale NMR-Spektroskopie, VCH, Weinheim, 1992.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.