Lexikon der Biologie: Ribozyme
Ribozyme, RNA-Enzyme, katalytisch wirksame Ribonucleinsäuren. Der Begriff Ribozym wird jedoch auch für Ribonucleoproteine verwendet, deren RNA-Anteil katalytische Funktion ausübt. Erstmals wurde die katalytische Eigenschaft von RNA beim Selbst-Spleißen (autosplicing) der 26S-rRNA (ribosomale RNA) des Ciliaten Tetrahymena thermophila beobachtet ( vgl. Abb. 1/1 und vgl. Abb. 1/2 ). Das Intron dieses RNA-Moleküls ist in der Lage, sich selbst, ohne Beteiligung von Proteinen, aus dem rRNA-Vorläufer-Molekül freizusetzen. Die RNA wirkt hier jedoch nicht katalytisch im eigentlichen Sinne, da sie sich selbst schneidet und damit nicht unverändert aus der Reaktion hervorgeht (Enzyme). Sog. quasi-katalytische Eigenschaften von RNA werden auch bei der Replikation des Genoms bestimmter Viroide beobachtet. Dort spalten sich nach dem rolling circle-Prinzip entstehende multimere RNA-Moleküle selbst in ihre Monomere. RNA-Moleküle sind jedoch auch in der Lage, „echte“ Katalysen durchzuführen. RNase P (Ribonucleasen) besitzt einen RNA-Anteil, der in vitro allein in der Lage ist, bei der Reifung von tRNA (transfer-RNA) das Vorläufer-Molekül endonucleolytisch zu spalten. In vivo sind jedoch, vermutlich zur Aufrechterhaltung der enzymatisch aktiven Struktur, auch die Proteine zur Katalyse notwendig. Die weiterprozessierte Form des Introns der 26S-rRNA aus Tetrahymena, L-19 IVS (linear minus 19 intervening sequence), ist ebenfalls in der Lage, in vitro als „echtes“ Enzym zu wirken, indem es die Synthese von Oligo-Ribonucleinsäuren katalysiert. Für den Nachweis, daß nicht nur Proteine, sondern auch RNA-Moleküle katalytisch wirken können, wurden T.R. Cech und S. Altman 1989 mit dem Nobelpreis für Chemie ausgezeichnet. Sie widerlegten mit ihrer Entdeckung den Lehrsatz, daß die Katalyse biologisch-chemischer Reaktionen ausschließlich von Proteinen (Enzymen) bewerkstelligt wird. Inzwischen sind Ribozyme in allen Organismengruppen gefunden worden. – Ribozyme binden in der Regel einen Substrat-RNA-Strang über Basenpaarung und können dann das Spalten des Phosphodiesterrückgrats katalysieren ( vgl. Abb. 2 ). Grundlage für die katalytische Aktivität ist die Ausbildung von Sekundärstrukturen ( vgl. Abb. 3 ) durch Paarung komplementärer Basen, die sich weiter zu dreidimensionalen Strukturen (Tertiärstruktur) falten. Man unterscheidet Ribozyme, die eine interne nucleophile Gruppe für die Katalyse aktivieren, von solchen, die ein externes Nucleophil verwenden. Im ersten Fall fungiert die 2'-OH-Gruppe der 5'-terminalen Ribose als internes Nucleophil und attackiert das zentrale Phosphoratom der Phosphodiesterbindung, wobei ein 2'-3'-zyklisches Phosphat und ein 5'-OH gebildet werden. Im anderen Fall attackiert ein externes Nucleophil (in der Regel eine Hydroxylgruppe, unter Umständen H2O) das zentrale Phosphoratom der Phosphodiesterbindung. Es entstehen eine 3'-OH-Gruppe und eine 5'-Phosphatgruppe, an die das eingangs attackierende Nucleophil gebunden ist. Zweiwertige Metallionen sind zum einen essentiell für die chemische Katalyse, zum anderen können sie, indem sie die negativen Ladungen der RNA neutralisieren, stabilisierend auf die räumliche Struktur der Ribozyme wirken. Ribozyme mit internem Nucleophil sind typischerweise klein (<100 Nucleotide) und weisen eine weniger komplexe Tertiärstruktur als Ribozyme der zweiten Gruppe auf, da sie keine Strukturen für Bindung, Orientierung und Aktivierung des externen Nucleophils benötigen. Die geringe Größe und die Sequenzspezifität der Reaktion machen solche Ribozyme zu vielversprechenden therapeutischen Agenzien ( vgl. Infobox ), vor allem gegen Viren (Virusinfektion; vgl. Abb. 4 ) und verschiedene Formen von Krebs. – In Anlehnung an natürlich vorkommende Ribozyme läßt sich eine Vielzahl künstlicher Derivate durch Verlagerung der katalytisch aktiven Region und der Substratregion auf distinkte RNA-Moleküle herstellen. Die katalytische Region kann durch die Trennung von der Substratregion immer wieder die Umsetzung neuer Substratmoleküle katalysieren. Die Technik der in-vitro-Evolution ermöglicht es weiterhin, Ribozyme mit völlig neuen katalytischen Eigenschaften zu erzeugen. Zu den Ribozymen mit internem Nucleophil gehören z.B. die sog. Hammerkopf-Ribozyme („hammerhead ribozymes“; vgl. Abb. 3 ), die von der selbstspleißenden Satelliten-RNA des Tabakringflecken-Virus (Satelliten, Tabakringflecken-Virusgruppe) abgeleitet sind. Für eine katalytische Aktivität reicht eine Hammerkopfstruktur aus, die sich aus 2 RNAs zusammensetzt, einer 19 Nucleotide langen RNA als katalytische Domäne und einer 24 Nucleotide langen als Substratsequenz. Modell für Hepatitis-Delta-Virus-Ribozyme ( vgl. Abb. 3 ) sind selbstspaltende Sequenzen, die sowohl in der genomischen als auch in der antigenomischen RNA des Hepatitis-Delta-Virus (HDV) vorhanden sind. HDV-Ribozyme weisen eine Axt-ähnliche Sekundärstruktur auf. Auch tRNAPhe aus Hefe und eine daraus abgeleitete Minimal-RNA sind in der Lage, sich intern zu spalten. Das kleinste momentan bekannte Ribozym, das Trinucleotid UUU, katalysiert die spezifische Spaltung des Tetranucleotids GAAA zwischen G und A. Dieses künstliche Ribozym führt deutlich vor Augen, daß bereits kleinste RNA-Moleküle spezifische Hydrolyse durch Metallionen dirigieren können. Zur Klasse von Ribozymen, die ein externes Nucleophil in ihren Reaktionen verwenden, gehören die von Gruppe-I- und Gruppe-II-Intronen (spleißen) abgeleiteten Ribozyme (Gruppe-I-Ribozyme bzw. Gruppe-II-Ribozyme) und der RNA-Anteil von RNase P (RNase P-RNA). Ursächlich für die relative Größe von Gruppe-I- ( vgl. Abb. 3 ) und Gruppe-II-Ribozymen ist neben den für die Bindung der Nucleophile notwendigen räumlichen Strukturen außerdem die Tatsache, daß sie die vielstufigen Prozesse eines kompletten Spleißvorgangs katalysieren und nicht nur einfache Spaltreaktionen. Die erhöhte strukturelle und mechanistische Komplexität erlaubt diesen, neben Spaltung von Phosphodiesterbindungen weitere Reaktionen zu katalysieren, u.a. Polymerisation, Ligation, Aminoacyl-Esterase-Aktivität und Insertionen in Nucleinsäurestränge. – Die Entdeckung katalytischer RNA ist auch im Hinblick auf präbiotische Evolutionsprozesse äußerst interessant. Da RNA-Moleküle sowohl Informationsträger und -überträger als auch Katalysator nucleolytischer und Ribonucleinsäure-polymerisierender Reaktionen sein können, werden sie als die ursprünglichen selbstreplizierenden biologischen Makromoleküle (Biopolymere) diskutiert. Hyperzyklus, Leben, RNA-Welt, RNP-Welt.
R.M./P.Z./M.B.
Lit.:Eckstein, F., Lilley, D.M.J.: Catalytic RNA. Berlin 1996.

Ribozyme
Abb. 1.1:
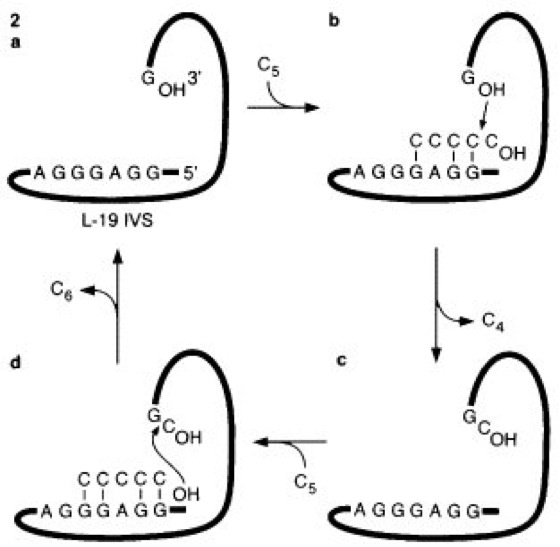
1 Das 26S-rRNA-Vorläufermolekül aus Tetrahymena kann ohne Unterstützung von Proteinen sein Intron herausschneiden und die beiden Exonen wieder miteinander verbinden. Die Aktivität des sich selbst prozessierenden RNA-Moleküls hat, da es nicht unverändert aus dem Reaktionsablauf hervorgeht, lediglich Enzym-ähnlichen Charakter.
Ribozyme
Abb. 1.2:
2 Das bei der unter 1 beschriebenen Selbstspleiß-Reaktion entstehende RNA-Molekül L-19 IVS (linear minus 19 intervening sequence) ist in der Lage, Oligoribonucleotide zu synthetisieren. Es geht regeneriert aus der Reaktion hervor, zeigt somit also den (Protein-)Enzymen vergleichbare katalytische Aktivität.

Ribozyme
Abb. 2: Durch ein Ribozym katalysierte Spaltung eines RNA-Moleküls an einer bestimmten Stelle
Ribozyme
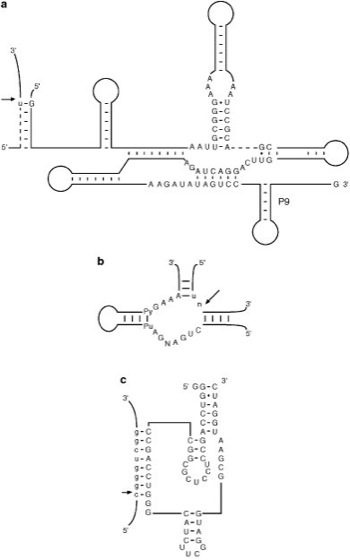
Abb. 3:Sekundärstrukturen einiger Ribozyme (Substratsequenzen sind in Kleinbuchstaben dargestellt; die Spaltstellen sind durch Pfeile markiert; N bzw. n = beliebiges Nucleotid, Pu = Purin, Py = Pyrimidin):
a Tetrahymena-Ribozym (Gruppe-I-Ribozym), b Hammerkopf-Ribozym, c Hepatitis-Delta-Virus-Ribozym

Ribozyme
Abb. 4: Ein retrovirales Verpackungssignal ψ führt zur Colokalisation des Ribozyms mit der viralen Ziel-RNA. Die gepaarte ribozymale RNA schneidet die komplementäre lacZ-Substratsequenz, so daß kein Genprodukt (β-Galactosidase) gebildet werden kann. LTR = long terminal repeat der ins Wirtsgenom integrierten retroviralen DNA.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.