Lexikon der Ernährung: Folsäure
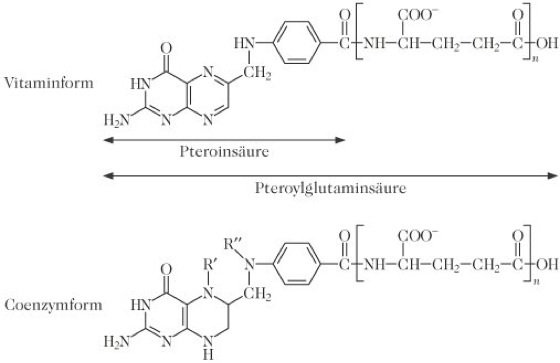
Folsäure, Pteroylglutaminsäure, E (br.) folic acid; (am.) folacin, besteht aus einem Pteridinring, an den p-Aminobenzoesäure mit Glutaminsäure an der Carboxylgruppe gebunden ist (PteGlu, n = 1; Abb.). Die Glutaminsäure kann an ihrer γ-Carboxylatgruppe mit weiteren Glutamatresten konjugiert sein (Polyglutamate, n = 3–7). F. und strukturell verwandte Substanzen mit der qualitativ gleichen biologischen Aktivität von Folsäure werden mit dem Sammelbegriff Folate bezeichnet (vgl. Folsäureäquivalente).
Eigenschaften: Kristalline F. ist eine orange-gelbe Substanz (λmax = 280–300 nm). Sie ist ein wasserlösliches Vitamin, instabil gegenüber Licht, sauren oder alkalischen Bedingungen und Hitze und oxidationsempfindlich.
Vorkommen: Folate kommen nicht nur in Lebensmitteln pflanzlicher Herkunft vor, sondern auch in tierischen Lebensmitteln, aus denen sie meist besser resorbiert werden. Als Vergleichgrundlage dienen Folsäureäquivalente (FÄ). Einen hohen Gehalt weisen Leber (bis 590 µg FÄ%), Blattgemüse (bis 180 µg FÄ%), Weizenkeime (520 µg FÄ%) und Hülsenfrüchte (150–190 µg FÄ%) auf. Mittlere Gehalte haben Fleisch und Fisch (bis 15 µg FÄ%), Getreideprodukte (bis 85 µg FÄ%), Nüsse (40–70 µg FÄ%) und Sonnenblumenkerne (90 µg FÄ%). Die Zubereitungsverluste betragen ca. 35 %. Die körpereigenen Reserven reichen für drei bis vier Monate aus.
Bedarf (nach DGE): Für Erwachsene liegt die Empfehlung bei 400 µg FÄ / d.
Resorption, Metabolismus: Folate werden als Monoglutamate über einen aktiven Transport (Na+-gekoppelt, pH-abhängig, Träger-vermittelt, Glucose-stimuliert) vor allem im proximalen Dünndarm resorbiert. Die in der Nahrung enthaltenen Polyglutamate werden durch eine γ-Glutamylcarboxypeptidase (im Bürstensaum der Darmmucosa lokalisierte, so genannte Konjugase) zur resorbierbaren Monoglutamatform abgebaut. Nach Resorption werden die Monoglutamate weitgehend ohne weitere Metabolisierung über das Gefäßsystem der Leber zugeführt und teilweise nach weiterer Metabolisierung an die Peripherie abgegeben. Im Serum findet man hauptsächlich 5-Methyl-Tetrahydrofolsäure (80 %), 10-Formyl-THF und 10-Formylpteroylglutaminsäure. 50–60 % der Serumfolatverbindungen sind unspezifisch an Proteine (α-Makroglobulin, Albumin, Transferrin) gebunden. Daneben gibt es ein spezifisches Folatbindungsprotein, an das Folat nur in geringer Menge (in pg) aber mit hoher Affinität bindet. Die zelluläre Aufnahme erfolgt Träger-vermittelt, benötigt Na+ und beschränkt sich auf Monoglutamatverbindungen. In den Zellen erfolgt eine Konjugation zu Polyglutamaten, die entweder gespeichert oder ihrer biologischen Coenzymfunktion zugeführt werden. Die Folatfreisetzung aus der Zelle erfolgt durch intrazelluläre Hydrolyse (lysosomale Folyl-Polyglutamyl-Hydrolase) und nachfolgenden Transfer durch die Zellmembran ins Serum.
5-Methyl-THF unterliegt einem enterohepatischen Kreislauf, der einen wesentlichen Faktor der Folathomöostase darstellt. Die gesamte Exkretion über den Urin ist bei adäquater Zufuhr auf Grund tubulärer Rückresorption der Folate gering (10–20 % der resorbierten Folatmonoglutamate). Neben intakten Folaten werden über den Urin auch Metabolite (Isoxanthopterin, p-Acetaminobenzoylglutamat, 4-Acetaminobenzoat) ausgeschieden.
Biochemische Funktionen: Folsäure entfaltet ihre Wirkung als 5,6,7,8-Tetrahydrofolsäure (auch als Coenzym F bezeichnet) und ihrer Derivate (FolsäureäquivalenteTab.) im Stoffwechsel der Proteine und Nucleotide. THF ist die entscheidende Coenzymform, die als Akzeptor und Überträger von Hydroxymethylgruppen (aktivierter Formaldehyd) und Formylgruppen (aktivierte Ameisensäure) fungiert. Diese C1-Reste (aktive Einkohlenstoffeinheiten) stammen aus verschiedenen Stoffwechselreaktionen, werden an THF gebunden und auf einen geeigneten Akzeptor übertragen. Derart katalysierte Umsetzungen im Aminosäurestoffwechsel sind in der Tabelle zusammengestellt.
Mangel: Folsäuremangel.
Überdosierung: Eine Überdosierung durch die Nahrung ist ausgeschlossen, die akute und chronische Toxizität sind niedrig. Bei Erwachsenen konnten bei chronischer Zufuhr von 400 mg / d über fünf Monate und 10 mg / d über fünf Jahre keine Nebenwirkungen beobachtet werden. Zu berücksichtigen ist, dass durch Gabe hoher Folsäure-Dosen ein Vitamin-B12-Mangel maskiert werden kann.
Therapie: Therapeutisch kommt Folsäure sowohl parenteral als auch oral zur Anwendung. Auf Grund der besonderen Bedeutung der Folsäure während der Schwangerschaft hat das Health Departement in England empfohlen, bei Frauen mit Kinderwunsch rechtzeitig eine Folsäuresubstitution durchzuführen. Durch Senkung erhöhter Homocysteinspiegel (Homocysteinämie, 400 µg / d) wirkt eine Folsäuregabe der Arteriosklerose entgegen.
Statusbestimmung: Durchgeführt wird eine Konzentrationsbestimmung sowohl im Serum, als auch in den Erythrocyten (da sich der Folsäurespiegel im Serum durch die aktuelle Aufnahme mit der Nahrung rasch ändert) mit Hilfe eines Histidinbelastungstests (= Formiminoglutaminsäure-Test, FIGLU-Test): Histidin wird über mehrere Schritte zu Formiminoglutaminsäure (FIGLU) metabolisiert (Tab.), das in einem weiteren Schritt, nach Aufnahme der Formiminogruppe durch THF, zu L-Glutamat abgebaut wird. Beim Gesunden finden sich im Urin in 24 h 0–6 mg FIGLU und nach Gabe von 15 g Histidin < 35 mg. Bei Folsäuremangel werden in 24 h ca. 12 mg FIGLU mit dem Urin ausgeschieden, unter Histidinbelastung 35–2000 mg.
Folsäure: Strukturformeln der Vitamin- und Coenzymform. Folsäure
Folsäure: Tab. Reaktionen, an denen Folsäure in der Coenzymform Tetrahydrofolat beteiligt ist.
| ||
| Aminosäurestoffwechsel | ||
| Serin → Glycin (THF → 5,10-Methylen-THF) Tryptophan → Formylkynurenin → Kynurenin Histidin → Formiminoglutaminsäure (FIGLU) → L-Glutaminsäure | Serinhydroxymethyltransferase (Vitamin-B6-abhängig) Formylase Formiminotransferase | |
| Proteinstoffwechsel | ||
| Homocystein → Methionin (5-Methyl-THF → THF) → Formylmethionin (10-Formyl-THF → THF) | Homocysteinmethyltransferase (Vitamin B12-abhängig) Methioninformyltransferase | |
| Formylmethionin mündet in die Proteinbiosynthese. Metabolische Aufgabe der Homocysteinmethyltransferase ist die Regenerierung von 5-Methyl-THF zu metabolisch aktiver THF. Bei einem Vitamin-B12-Mangel ist diese Reaktion blockiert (Methyl-Tetrahydrofolat-Falle), was zu einem Mangel an THF führt. | ||
| Purinsynthese | ||
| Formylierung von Glycinamidribonucleotid durch 5,10-Methenyl-THF Formylierung von Amino-Imidazol-Carboxamid-Ribonucleotid durch 10-Formyl-THF | Glycinamidribotidformylase Amino-Imidazol-Carboxamid-Ribotid-Transformylase | |
| Pyrimidinsynthese | ||
| Desoxyuridylat (dUMP) → Thymidylat (TMP) + Dihydrofolat (DHF; 5,10-Methylen-THF → DHF) | Thymidylatsynthase | |
| DHF wird durch die Dihydrofolatreduktase wieder zu THF reduziert. Diese Reaktion kann durch die Folsäure-Antagonisten Aminopterin und Methotrexat blockiert werden, die somit den für die Biosynthese der Purine und Pyrimidine wichtigen C1-Stoffwechsel hemmen. Durch Zufuhr von 5-Formyl-THF (Citrovorum-Faktor) kann diese Blockade aufgehoben werden. | ||






Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.