Virologie: Die Waffe des Virus, umgekehrt
Nach zwanzig Jahren intensiver Forschung ist manches besser geworden für HIV-Infizierte und eines geblieben: Die Krankheit bleibt unheilbar. Dies könnte sich mit Hilfe einer neuen Bekämpfungsstrategie vielleicht endlich ändern. Mit etwas Glück sogar in deutlich weniger als zwanzig Jahren.
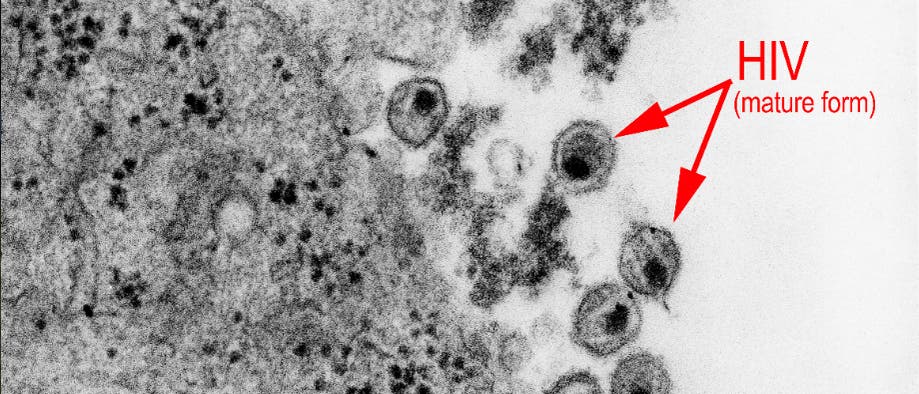
© CDC (Ausschnitt)
Natürlich gibt es schon seit langer Zeit billige, leicht verfügbare Mittel, gegen die auch das HI-Virus völlig hilflos ist. Zum Beispiel ein schlichtes Kondom. Mit ihm und völliger Enthaltsamkeit ist dann die kurze Liste verlässlicher Methoden schon komplett, die in der Theorie den totalen Erfolg gegen die tödliche Krankheit versprechen.
In der Praxis, allzu oft also leider nach der Infektion, bleibt allerdings bislang nur ein teurer, in Jahren kostspieliger, oft frustrierender Forschung hart erkämpfter Notfallplan für jene Privilegierten, die ihn sich leisten können: ein aufwändiger Medikamenten-Mix gegen vier angreifbare Achillesfersen, die das Virus während seinem zellulären Überfall offenbart. Auch immer neue Kombinationsangriffe auf den Eindringling können den HIV-Patienten nicht heilen, den Ausbruch von Aids und den immer noch unausweichlichen Tod jedoch immerhin verzögern. Das Virus nach der Infektion aber so massiv zu treffen, dass es völlig verschwindet, blieb bislang ein ferner Wunschtraum.
Ein paar Schritte weiter vom Traum zur Realität gehen nun eine Gruppe deutscher Forscher vom Heinrich Pette Institut für Experimentelle Virologie in Hamburg und dem Dresdener Max-Planck-Institut für Molekulare Zellbiologie und Genetik. Die Forscher hoffen, den Aids-Erreger in seinem bislang nicht angreifbaren Rückzugsraum mit seinen eigenen Waffen schlagen zu können.
Scherenangriff auf die Reserve
Ansatzpunkt einer HIV-Bekämpfung waren bislang die für das Virus kritischen Schritte des Enterns von menschlichen Zellen sowie der komplexe Apparat, mit dem er sein Erbgut von RNA in DNA umschreibt und seine Gene in die Zellkerne seiner Opfer integriert. Medikamente gegen diese Prozesse stoppen oft recht effizient eine HIV-Ausbreitung von infizierter, viralen Nachschub produzierender Zelle zu uninfizierter Zelle. Damit alleine ist die Krankheit aber nur gebremst, denn stets bleibt im Körper ein Reservoir an viraler DNA, die sich bereits in das Genom eingebaut hat und dort immer latent gefährlich bleibt – als so genanntes Provirus. Gegen diese Proviren war bislang kein Kraut gewachsen: ein Hauptgrund dafür, dass eine HIV-Infektion unheilbar ist.
Frank Buchholz und seine Mitstreiter möchten dem Virus nun so aus seinem DNA-Versteck entfernen, wie er hineingekommen ist. Das Virus-Erbgut, umgeschrieben in DNA, nutzte dazu eine so genannte Integrase: ein Enzym, dass den Doppelstrang der menschlichen DNA gezielt zerschneidet, um dann die beiden freien Bruch-Enden mit den Enden des Virus-DNA-Doppelstranges zu verbinden – drin ist die Viren-DNA. Integrasen können aber im Prinzip auch das Gegenteil, und so waren Wissenschaftler schon früh auf die Idee gekommen, diesen Prozess einfach umzudrehen, um das Virus aus dem Menschen-Erbgut herauszuschnipseln.
Die Schwierigkeit ist dabei allerdings, die kurze virale DNA in den Unmengen menschlicher DNA-Sequenzen zu erkennen und gezielt ohne Kollateralschäden zu entfernen. Ein viel versprechendes mögliches Werkzeug für beide Zwecke ist die ursprünglich aus dem Bakteriophagen P! extrahierte Rekombinase Cre, die schon seit Jahren in Genlabors weltweit als universales DNA-Cut-and-Paste-Werkzeug ihren Dienst tut. Sie schneidet DNA gezielt an bestimmten, genau bekannten Sequenzen, den so genannten loxP-Stellen aus 34 Basenpaaren. Spannenderweise entspricht die loxP-Basenabfolge zu etwa 50 Prozent einer Sequenz, die sich an den Enden des HIV-Genoms wiederholt.
Verbesserte Erkennung
Mit ein wenig Tuning in den Erkennungssequenzen, so dachten nicht erst Buchholz und Kollegen, könnte es möglich sein, dass die Rekombinase nicht ihre orginale loxP-Sequenz erkennt und schneidet, sondern genauso gerne die ähnliche, "loxLTR" getaufte Sequenz im HI-Virus. Ließe man die Rekombinase dann auf menschliche DNA mit integrierten HI-Viren los, dann müsste die maßgeschneiderte Rekombinase die Proviren gezielt herausschneiden – und damit die Zellen heilen.
Die deutschen Forscher machten sich mit diesem Ziel daran, die für die Erkennung der DNA-Schnittstellen-Sequenz verantwortlichen Abschnitt der Cre-Rekombinase subtil zu verändern und solche Varianten zu isolieren, die mehr und mehr auch auf loxLTR von HIV ansprachen. Nach insgesamt 126 Durchläufen ihres Enzym-Evolutionsprozesses hatten sie tatsächlich ein nützliches Wirkzeug namens Tre geschaffen – eine echte Anti-HIV-Rekombinase. Tre setzten die Wissenschaftler dann auf eine HIV-infizierte menschliche Zellkultur an und stellten erfreut fest, dass ihre Rekombinase tatsächlich alle HI-Proviren säuberlich aus dem Genom dieser Zellen eliminieren konnte.
Ist dies ein Durchbruch in der HIV-Bekämpfung? Ein interessanter Fortschritt sicher. Nach dem zukünftigen klinischen Nutzwert von Tre gefragt, müssen Kommentatoren wie Alan Engelman, HIV-Forscher der Dana-Farber Cancer Institutes, dennoch viele Worte und einige Einschränkungen machen. Zunächst sollte natürlich die Enzymschere weiter verbessert werden – beispielsweise müssen gezielt Werkzeuge für die verschiedene Stämme von HIV-1 verfügbar sein, die alle in Patienten vorkommen können. Noch steht auch nicht fest, ob das Virus an den Stellen, die von Tre erkannt werden, mutieren könnte. Dies ist unwahrscheinlich – es handelt sich um im Laufe der viralen Evolution vergleichsweise sehr konservierte Regionen –, aber möglich.
Sehr langwierig und kompliziert dürfte es aber auf jeden Fall werden, eine Therapie zu entwickeln, die einmal HIV-Infizierten tatsächlich helfen könnte. Davor müsse, so Joachim Hauber vom Heinrich-Pette-Institut, etwa geprüft werden, wie die Rekombinase überhaupt sicher und effizient in die infizierten Zellen des Körpers transportiert werden kann – und dann, ob die Rekombinase an Ort und Stelle fatale Nebenwirkungen bei ihrem Herumschneiden in der DNA hat. Der Ansatz werde daher sehr wahrscheinlich keinen unmittelbaren therapeutischen Nutzen haben, schreiben die Forscher.
Vielleicht am viel versprechendsten mag nach Hauber dann in der Zukunft sein, Blut-Stammzellen aus Patienten zu isolieren, sie im Labor per Tre von Viren zu befreien und dann zurück zu transplantieren: Diese Zellen könnten dann den Grundstock für eine HIV-freie Population bilden. Selbst im optimistischsten Fall dürfte es allerdings noch mehr als eine Dekade dauern, bis verbesserte Enzymscheren auf die HI-Viren von Erkrankten losgehen können. Bis dahin bleibt für Kranke die Hoffnung und für Gesunde der Hinweis auf die altbekannten Hochwirksamkeits-HIV-Bremsen aus Gummi. Mit etwas Glück wird der in den kommenden zehn Jahren nicht als hoffnungslos altbacken ignoriert.
In der Praxis, allzu oft also leider nach der Infektion, bleibt allerdings bislang nur ein teurer, in Jahren kostspieliger, oft frustrierender Forschung hart erkämpfter Notfallplan für jene Privilegierten, die ihn sich leisten können: ein aufwändiger Medikamenten-Mix gegen vier angreifbare Achillesfersen, die das Virus während seinem zellulären Überfall offenbart. Auch immer neue Kombinationsangriffe auf den Eindringling können den HIV-Patienten nicht heilen, den Ausbruch von Aids und den immer noch unausweichlichen Tod jedoch immerhin verzögern. Das Virus nach der Infektion aber so massiv zu treffen, dass es völlig verschwindet, blieb bislang ein ferner Wunschtraum.
Ein paar Schritte weiter vom Traum zur Realität gehen nun eine Gruppe deutscher Forscher vom Heinrich Pette Institut für Experimentelle Virologie in Hamburg und dem Dresdener Max-Planck-Institut für Molekulare Zellbiologie und Genetik. Die Forscher hoffen, den Aids-Erreger in seinem bislang nicht angreifbaren Rückzugsraum mit seinen eigenen Waffen schlagen zu können.
Scherenangriff auf die Reserve
Ansatzpunkt einer HIV-Bekämpfung waren bislang die für das Virus kritischen Schritte des Enterns von menschlichen Zellen sowie der komplexe Apparat, mit dem er sein Erbgut von RNA in DNA umschreibt und seine Gene in die Zellkerne seiner Opfer integriert. Medikamente gegen diese Prozesse stoppen oft recht effizient eine HIV-Ausbreitung von infizierter, viralen Nachschub produzierender Zelle zu uninfizierter Zelle. Damit alleine ist die Krankheit aber nur gebremst, denn stets bleibt im Körper ein Reservoir an viraler DNA, die sich bereits in das Genom eingebaut hat und dort immer latent gefährlich bleibt – als so genanntes Provirus. Gegen diese Proviren war bislang kein Kraut gewachsen: ein Hauptgrund dafür, dass eine HIV-Infektion unheilbar ist.
Frank Buchholz und seine Mitstreiter möchten dem Virus nun so aus seinem DNA-Versteck entfernen, wie er hineingekommen ist. Das Virus-Erbgut, umgeschrieben in DNA, nutzte dazu eine so genannte Integrase: ein Enzym, dass den Doppelstrang der menschlichen DNA gezielt zerschneidet, um dann die beiden freien Bruch-Enden mit den Enden des Virus-DNA-Doppelstranges zu verbinden – drin ist die Viren-DNA. Integrasen können aber im Prinzip auch das Gegenteil, und so waren Wissenschaftler schon früh auf die Idee gekommen, diesen Prozess einfach umzudrehen, um das Virus aus dem Menschen-Erbgut herauszuschnipseln.
Die Schwierigkeit ist dabei allerdings, die kurze virale DNA in den Unmengen menschlicher DNA-Sequenzen zu erkennen und gezielt ohne Kollateralschäden zu entfernen. Ein viel versprechendes mögliches Werkzeug für beide Zwecke ist die ursprünglich aus dem Bakteriophagen P! extrahierte Rekombinase Cre, die schon seit Jahren in Genlabors weltweit als universales DNA-Cut-and-Paste-Werkzeug ihren Dienst tut. Sie schneidet DNA gezielt an bestimmten, genau bekannten Sequenzen, den so genannten loxP-Stellen aus 34 Basenpaaren. Spannenderweise entspricht die loxP-Basenabfolge zu etwa 50 Prozent einer Sequenz, die sich an den Enden des HIV-Genoms wiederholt.
Verbesserte Erkennung
Mit ein wenig Tuning in den Erkennungssequenzen, so dachten nicht erst Buchholz und Kollegen, könnte es möglich sein, dass die Rekombinase nicht ihre orginale loxP-Sequenz erkennt und schneidet, sondern genauso gerne die ähnliche, "loxLTR" getaufte Sequenz im HI-Virus. Ließe man die Rekombinase dann auf menschliche DNA mit integrierten HI-Viren los, dann müsste die maßgeschneiderte Rekombinase die Proviren gezielt herausschneiden – und damit die Zellen heilen.
Die deutschen Forscher machten sich mit diesem Ziel daran, die für die Erkennung der DNA-Schnittstellen-Sequenz verantwortlichen Abschnitt der Cre-Rekombinase subtil zu verändern und solche Varianten zu isolieren, die mehr und mehr auch auf loxLTR von HIV ansprachen. Nach insgesamt 126 Durchläufen ihres Enzym-Evolutionsprozesses hatten sie tatsächlich ein nützliches Wirkzeug namens Tre geschaffen – eine echte Anti-HIV-Rekombinase. Tre setzten die Wissenschaftler dann auf eine HIV-infizierte menschliche Zellkultur an und stellten erfreut fest, dass ihre Rekombinase tatsächlich alle HI-Proviren säuberlich aus dem Genom dieser Zellen eliminieren konnte.
Ist dies ein Durchbruch in der HIV-Bekämpfung? Ein interessanter Fortschritt sicher. Nach dem zukünftigen klinischen Nutzwert von Tre gefragt, müssen Kommentatoren wie Alan Engelman, HIV-Forscher der Dana-Farber Cancer Institutes, dennoch viele Worte und einige Einschränkungen machen. Zunächst sollte natürlich die Enzymschere weiter verbessert werden – beispielsweise müssen gezielt Werkzeuge für die verschiedene Stämme von HIV-1 verfügbar sein, die alle in Patienten vorkommen können. Noch steht auch nicht fest, ob das Virus an den Stellen, die von Tre erkannt werden, mutieren könnte. Dies ist unwahrscheinlich – es handelt sich um im Laufe der viralen Evolution vergleichsweise sehr konservierte Regionen –, aber möglich.
Sehr langwierig und kompliziert dürfte es aber auf jeden Fall werden, eine Therapie zu entwickeln, die einmal HIV-Infizierten tatsächlich helfen könnte. Davor müsse, so Joachim Hauber vom Heinrich-Pette-Institut, etwa geprüft werden, wie die Rekombinase überhaupt sicher und effizient in die infizierten Zellen des Körpers transportiert werden kann – und dann, ob die Rekombinase an Ort und Stelle fatale Nebenwirkungen bei ihrem Herumschneiden in der DNA hat. Der Ansatz werde daher sehr wahrscheinlich keinen unmittelbaren therapeutischen Nutzen haben, schreiben die Forscher.
Vielleicht am viel versprechendsten mag nach Hauber dann in der Zukunft sein, Blut-Stammzellen aus Patienten zu isolieren, sie im Labor per Tre von Viren zu befreien und dann zurück zu transplantieren: Diese Zellen könnten dann den Grundstock für eine HIV-freie Population bilden. Selbst im optimistischsten Fall dürfte es allerdings noch mehr als eine Dekade dauern, bis verbesserte Enzymscheren auf die HI-Viren von Erkrankten losgehen können. Bis dahin bleibt für Kranke die Hoffnung und für Gesunde der Hinweis auf die altbekannten Hochwirksamkeits-HIV-Bremsen aus Gummi. Mit etwas Glück wird der in den kommenden zehn Jahren nicht als hoffnungslos altbacken ignoriert.

Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.