Vogelgrippe: Fünf Fragen zu H5N1
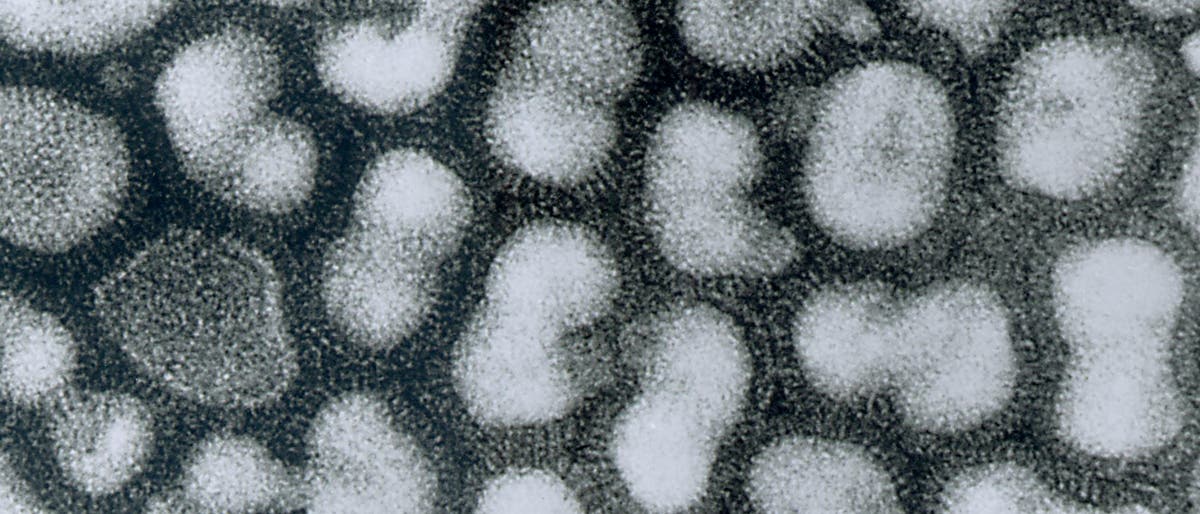
Die Biologie des H5N1-Vogelgrippevirus steckt voller Widersprüche. Das Virus ist weit verbreitet, aber schwer zu entdecken. Es tötet mehr als die Hälfte der Menschen, bei denen eine Infektion entdeckt wurde, aber Tausende, die ihm ausgesetzt waren, zeigen keinerlei Beschwerden. Es scheint nur wenige Mutationsschritte von der Fähigkeit entfernt, sich von Mensch zu Mensch zu übertragen, und doch hat es diese Schritte in über 16 Jahren rascher Entwicklung nicht vollzogen.
Diesen Juni deckten Wissenschaftler die Mutationen auf, welche H5N1 befähigen, sich durch die Luft von einem Frettchen zum anderen auszubreiten. Diese Arbeiten, zum einen von einer Gruppe unter der Leitung von Ron Fouchier am Erasmus Medical Center in Rotterdam [1] und eine andere von Yoshihiro Kawaoka an der University of Wisconsin-Madison und seinen Kollegen [2], wurden heftig diskutiert, denn einige sahen darin ein Rezept für eine hausgemachte Katastrophe: Die Arbeiten an den Viren erhöhten das Risiko einer versehentlichen oder absichtlichen Freisetzung eines für den Menschen tödlichen Erregers.
Was aber unter vielen Vertretern der Grippeforschung als noch beunruhigender aufgefasst wird, ist die in diesen Arbeiten vermittelte Erkenntnis, dass das Virus auch ohne Zutun eine Pandemie auslösen könnte. Diese Bedrohung lässt die ungelösten wissenschaftlichen Geheimnisse um dieses kleine RNA-Virus, dessen Genom gerade einmal 14 000 Gene umfasst, noch dringlicher erscheinen. Wir präsentieren fünf der größten Rätsel und was Wissenschaftler tun, um diese zu lösen.
Warum ist es so erfolgreich?
Der Name H5N1 ergibt sich aus der Kombination zweier Proteine an der Oberfläche des Virus, nämlich Hämagglutinin (HA) und Neuraminidase. Es gibt jedoch viele verschiedene Stämme von H5N1. Der hochgradig pathogene Stamm, der sich über eine Dekade in den Schlagzeilen hielt, wurde zum ersten Mal 1996 identifiziert. Man taufte ihn Gs/Gd, da er in Hausgänsen in der chinesischen Provinz Guangdong gefunden wurde und sich nach Aussage des Virologen Robert Webster vom St. Jude Children's Research Hospital in Memphis im US-Bundesstaat Tennessee "gänzlich von jedem bis dato entdeckten Vogelgrippevirus unterscheidet". Die meisten Vogelgrippeviren sind harmlos, da sie Wildvögel als Wirte verwenden und nur gelegentlich zu tödlichen, aber kurzlebigen Ausbrüchen unter Zuchtgeflügel führen. Der Gs/Gd-Stamm sprang jedoch von Geflügel wieder auf Wildvögel zurück. Er infiziert auch Säugetiere wie Menschen, Tiger, Pfeifhasen, Zibetkasten und andere. Er hat sich in 63 Länder verbreitet und ist in sechs davon in Vogelpopulationen endemisch.
"Was ist so besonders an diesem Virus, dass es sich so effektiv in der Tierwelt verbreiten kann?", fragt der Tropenmediziner Jeremy Farrar von der University of Oxford. Es gibt keine gesicherte Antwort.
"Was ist so besonders an diesem Virus, dass es sich so effektiv in der Tierwelt verbreiten kann?"
Jeremy Farrar
Chinas überfüllte Farmen und Märkte, die eine bunte Mischung möglicher Wirte bieten, könnten als Nährboden für Artengrenzen überschreitende Viren dienen. Die Bemühungen schlugen fehl, es bei Zuchtgeflügel auszurotten. Daraufhin veränderte sich das Virus in den Jahren 1999 und 2000 rasant und zahlreiche neue Entwicklungslinien entstanden. In dieser Zeit übernahm eine Klade der Gs/Gd-Linie mit der Bezeichnung 2.2 eine Mutation im Protein PB2, einem der drei Polymerase-Gene, die dem Virus ermöglichen, sein Genom zu kopieren. Diese Mutation wird weithin als Anpassung an Säugetierwirte angesehen.
2002 sprang das Virus aus bisher ungeklärten Gründen wieder auf Wildvögel zurück und begann, sie zu töten. Zunächst gab es nur wenige isolierte Todesfälle, aber im Mai 2005 waren Viren der Klade 2.2 für den Tod von über 6000 Gänsen, Möwen und Enten auf dem Qinghai-See verantwortlich, dem größten See in China und einer wichtigen Brutstätte für Zugvögel. Dieser Ausbruch läutete den Anfang einer globalen Reise ein, in deren Verlauf sich das Virus durch Vogelhandel und Zugvögel im übrigen Asien, Europa und Afrika ausbreitete. Durch Impfungen konnte das Virus in Hongkong und Vietnam unter Kontrolle gebracht werden, aber wo diese Impfungen planlos verliefen, beschleunigten sie lediglich die Entwicklung des Virus. In Ägypten entstanden so zahlreiche neue Unterkladen [3], und das Land weist nun mehr neue menschliche Fälle auf als jedes andere Land seit 2009.
Es gibt auch gute Nachrichten: Die Infektionsrate unter Wildvögeln ist seit 2006 stark gesunken. Doch mit dem Verschwinden alter Linien entstehen wieder neue, wie die Klade 2.3.2.1, die seit Anfang 2011 unter Geflügel in Asien wütete. "Das bereitet mir die größten Sorgen", so Webster. "Es scheint dominant zu werden und greift bereitwillig auf Wildvögel über." H5N1 scheint sich schneller zu entwickeln, als unsere Fähigkeit, es zu verstehen.
Wo ist es jetzt?
H5N1 scheint gleichzeitig überall und nirgendwo zu sein. Dadurch ist es so schwierig abzusehen, wann, wo und ob es sich zu einer menschlichen Pandemie zusammenbrauen wird.
Wildvögel sind H5N1-Träger, aber das Virus kann schwer zu entdecken sein, da nur wenige daran erkranken. Es weiß auch niemand, wie weit es unter Menschen verbreitet ist. Bis zum 10. August 2012 hat die WHO 608 H5N1-Fälle an Menschen erfasst, von denen 359 tödlich verliefen (Aktualisierung durch die Redaktion). Viele vermuten, dass die tatsächliche Zahl viel größer ist, so dass die Sterblichkeitsrate weit unter 60 Prozent liegen würde. Der Virologe Peter Palese von der Mount Sinai School of Medicine in New York hat eine Reihe von Studien gesichtet, die eine H5N1-Infektion im Blut gesunder Menschen nachweisen konnten. Er schätzt, dass ein bis zwei Prozent der Bevölkerung, die dem Virus ausgesetzt ist, infiziert werden, die meisten davon jedoch ohne oder nur mit schwachen Symptomen [4].
Paleses Aussagen sind umstritten. Farrar, der Patienten in Asien behandelt hat, sagt, er habe vor allem schwere Fälle gesehen. "Wenn viele harmlos verlaufende Infektionen auftreten, würden wir angesichts der Sensibilisierung der Öffentlichkeit und der Mediziner mehr Patienten mit weniger ernsten Symptomen in den Krankenhäusern erwarten", erklärt er.
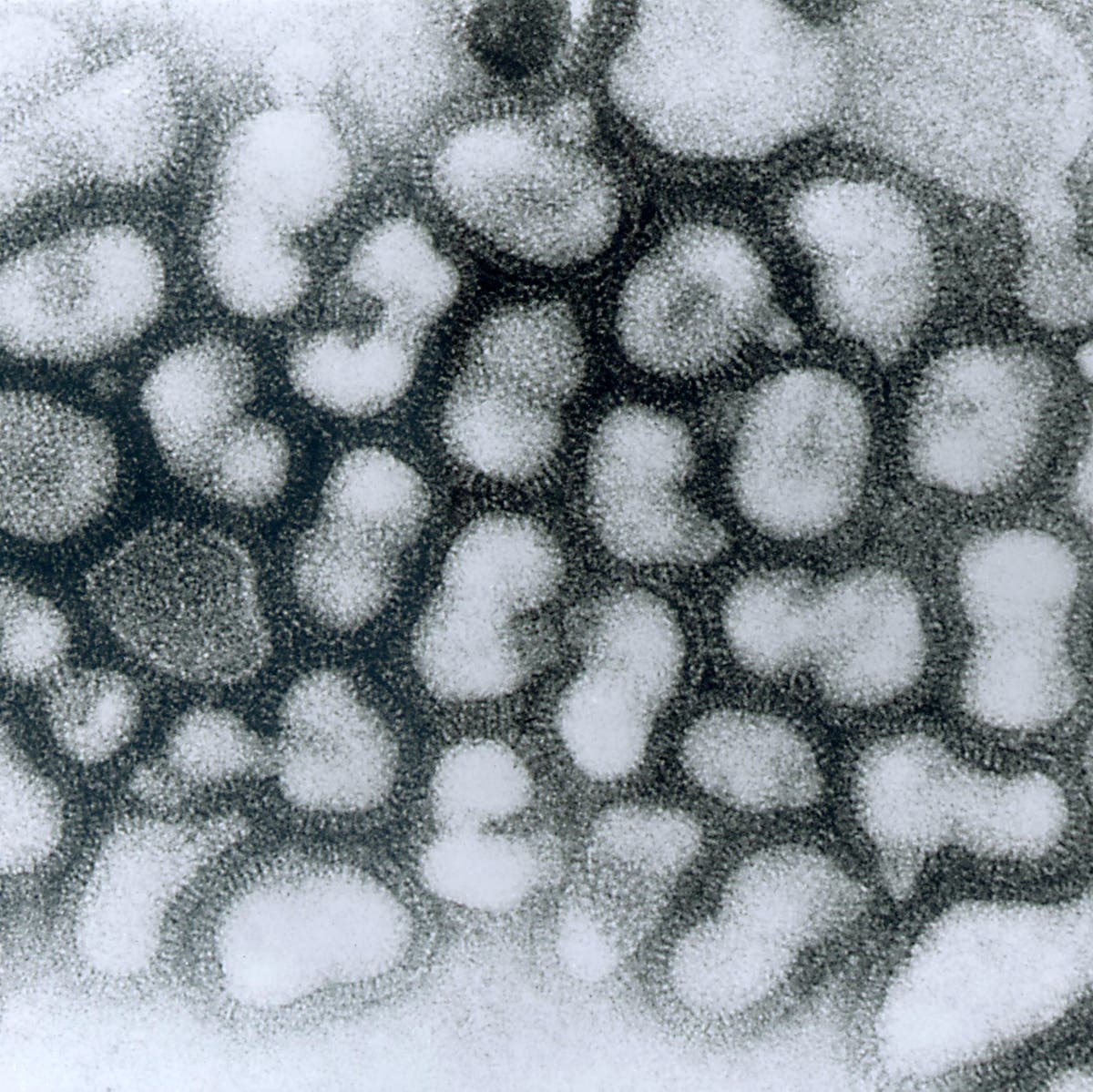
Der Debatte um die Infektionsrate liegt mangelndes Wissen zu Grunde, wie das Immunsystem auf das Virus reagiert. Infizierte Menschen entwickeln Antikörper und T-Zellen, die das Virus erkennen, aber niemand weiß, wie diese Reaktionen mit der Zeit steigen oder sinken oder wie sie in Menschen aussehen, die keine Symptome zeigen. Die Signale könnten auch einfach einen falschen Alarm darstellen. "Wenn Sie jeden Tag im Hühnerhaus Vogelkot auskehren, der voller Virusantigene steckt, könnte auch ohne Infektion eine Antikörperreaktion auftreten", erklärt Fouchier. Seiner Meinung nach ist eine sorgfältigere Beobachtung von Verdachtsfällen erforderlich, um die Debatte zu beenden, wie häufig Menschen angesteckt werden. Farrar fügt hinzu, dass solche Studien mehrere Jahre andauern müssen, um zu erfahren, wie sich die Immunreaktion mit der Zeit verändert. Viele Forscher fordern zudem eine bessere Überwachung von Haus- und Wildtieren.
Für die Veterinärvirologin Ilaria Capua vom Istituto Zooprofilattico Sperimentale delle Venezie in Legnaro ist die Verbreitung von H5N1 das wichtigste und das schwierigste Thema. "Jede Vorhersage, ob dieses Virus pandemisch wird, hängt davon ab, wo es wie stark konzentriert ist und wie wahrscheinlich Kontakte zwischen Menschen und Tieren sind. Die Informationen sind jedoch mehr als löchrig."
Wie tötet es?
Die Wissenschaftler bringen nach und nach die genetischen Faktoren ans Licht, die H5N1 so tödlich machen. Das Virus enthält in seinen drei Polymerase-Genen verschiedene Mutationen, die ihm eine aggressive Vermehrung erlauben, und Patienten, die daran sterben, zeigen die höchsten Konzentrationen an viraler RNA. Durch bestimmte HA-Veränderungen, die ein Protein kodieren, das sich in Wirtszellen einklinkt, kann das Virus nicht nur Gewebe in Lunge und Darm, sondern zum Beispiel auch im Gehirn befallen. Dieser Freifahrschein lässt das Virus Frettchen, Mäuse und Vögel töten, ist aber offenbar bei Primaten weniger wichtig. "Beim Menschen sieht es immer noch überwiegend so aus, als sterben die Patienten an einer Atemwegserkrankung", so der klinische Virologe Malik Peiris von der Universität Hongkong. Autopsien könnten mehr Aufschluss geben, werden in Asien jedoch selten zugelassen, da die Kultur eine Ganzkörperbestattung vorschreibt.
Bei H5N1 spielt auch das Immunsystem verrückt. Immunzellen sammeln sich an Infektionsherden und produzieren entzündliche Stoffe, so genannte Zytokine, die weitere Immunzellen anlocken. Das Ergebnis, ein regelrechter "Zytokinsturm", der die Lungen mit Flüssigkeit überflutet und benachbarte Gewebe irreparabel schädigt, ist dann häufig die Todesursache. H5N1 löst einen größeren Ansturm aus, als die bei Menschen üblichen Grippeviren H1N1 oder H3N2. Diese Faktoren mögen zwar die Schwere der gemeldeten Fälle erklären, nicht jedoch, warum nur so selten Infektionen auftreten. "Warum haben wir bei Zehntausenden von Kindern, die mit erkrankten Hühnern spielen, im Laufe von neun Jahren nur 600 Infektionen verzeichnet?", fragt der Immunologe Anthony Fauci, Leiter des National Institute of Allergy and Infectious Diseases in Bethesda im US-Bundesstaat Maryland.
Palese vermutet, dass schwere Fälle einfach besonders hohe Konzentrationen des Virus eingeatmet haben. Peiris hält dies als alleinige Erklärung jedoch nicht für ausreichend. "Infektion und Erkrankung sind nicht direkt proportional zum Kontakt. Neunundneunzig Komma neun Prozent der Personen, die massiven Dosen ausgesetzt sind, erkranken nicht und weisen auch keine Antikörper im Blut auf. In Erkrankten vermehrt sich das Virus jedoch wie verrückt." Es ist auffällig, dass diese Fälle häufig innerhalb derselben Familie, vornehmlich unter Blutsverwandten, auftreten. Diese Menschen könnten genetisch besonders anfällig für H5N1 sein, oder die anderen verfügen über genetische Varianten, die sie schützen. Die Suche nach diesen Varianten wird sich als schwierig erweisen, da nur 300 der Erkrankten weltweit die Infektion überlebt haben, aber Studien geben erste Hinweise.
Vor wenigen Monaten fand eine Gruppe vom Wellcome Trust Sanger Institute im britischen Hinxton heraus, dass das Gen IFITM3 bei der Reaktion auf einige Grippeinfektionen eine entscheidende Rolle spielt [6]. Eine Variante dieses Gens, das ein fehlerhaftes Protein kodiert, fand sich in überhöhtem Maße bei Menschen, die mit Stämmen pandemischer oder saisonaler Grippeviren ins Krankenhaus kamen, und bei Mäusen ohne dieses Gen konnte selbst ein schwaches H3N2-Virus in der Lunge Amok laufen. Farrar hat gerade erst eine ähnliche Studie an 67 asiatischen Patienten abgeschlossen, die mit H5N1 eingeliefert wurden. In den zur Veröffentlichung eingereichten Ergebnissen finden sich Varianten in zwei weiteren Genen, die anscheinend eine Anfälligkeit für das Virus verursachen.
Wird es zwischen Menschen übertragbar werden?
Bisher scheinen H5N1 nur durch engen Kontakt zu infizierten Vögeln auf Menschen übertragen zu werden. Für eine Verbreitung von Mensch zu Mensch müsste es per Tröpfcheninfektion über die Luft übertragbar werden. Die beiden im Sommer veröffentlichten Arbeiten zeigen, dass diese Möglichkeit besteht.
Fouchier zielte darauf ab, HA so zu verändern, dass sein Protein anstelle von Rezeptoren an der Oberfläche von Vogelzellen solche in den oberen Atemwegen von Säugetieren erkennt [1]. Dann ließ er das Virus zwischen Frettchen wandern und sich entwickeln, bis es sich durch Husten und Schnupfen übertragen ließ. Kawaoka verfuhr ähnlich [2], verschmolz dabei jedoch ein mutiertes HA von H5N1 mit anderen Genen von pandemischen H1N1-Stämmen aus dem Jahr 2009. "Im Prinzip kann H5N1 durch die Luft übertragbar werden", erklärt Fouchier. "Die kritische Frage dabei ist, ob es das auch wird."
"Im Prinzip kann H5N1 durch die Luft übertragbar werden. Die kritische Frage dabei ist, ob es das auch wird"
Ron Fouchier
Eine der größten Fragen zu H5N1 lautet, warum es nach so vielen Jahren im Umlauf noch nicht übertragbar geworden ist. Bisher hat niemand eine gute Antwort darauf. Viele der von Fouchier und Kawaoka identifizierten Mutationen wurden auch bereits in der freien Natur gefunden. Bei der Recherche in entsprechenden Datenbanken fand der Bioinformatiker Derek Smith von der University of Cambridge heraus, dass viele wilde Kladen nur noch zwei oder vier Mutationen von den Sets entfernt sind, die Fouchier und Kawaoka gefunden haben [7].
Smith konnte das tatsächliche Risiko nicht bestimmen, da Monitoringdaten die genetische Vielfalt des Virus verschleiern. H5N1 vermehrt sich mit Fehlern, so dass jeder Patient einen Schwarm von Viren mit minimalen genetischen Abweichungen in sich trägt. Die Datenbank enthält lediglich eine "Kompromiss"-Sequenz, die im Wesentlichen ein Gemisch der häufigsten Varianten an der jeweiligen Position im Genom aufweist. Nur eine genauere Sequenzierung, bei der jede Position viele Male gelesen wird, kann alle Varianten erschließen.
Selbst wenn dieselbe Kombination von HA-Mutationen, die Fouchier und Kawaoka gefunden haben, im natürlichen Umfeld entsteht, kann niemand vorhersagen, ob das resultierende Virus so leicht von Mensch zu Mensch übertragen würde, wie es im Labor unter den Frettchen geschah. Ebenso ist unklar, wie die übrigen Gene von H5N1 zur Übertragbarkeit beitragen oder ob unterschiedliche Kombinationen von Mutationen den gleichen Effekt hätten. "Die haben nur an der Oberfläche gekratzt", meint Webster.
Laut Fouchier und Kawaoka liegt der Wert ihrer Arbeit in der Identifikation der physischen Merkmale, die H5N1 übertragbar machen. Einige Mutationen befähigen HA Säugetierrezeptoren zu erkennen, andere stabilisieren das Protein. "Kann man mit Hilfe dieser Merkmale jedes Grippevirus durch die Luft übertragbar machen?", fragt Fouchier. Die Virulenz eines übertragbaren Stamms ist eine weitere Unbekannte. Eine Hypothese geht davon aus, dass die Virulenz mit zunehmender Übertragbarkeit gehemmt wird. Ein aerogenes H5N1 könnte zum Beispiel Rezeptoren in den oberen Luftwegen erkennen. Gleichzeitig wäre es weniger geneigt, sich mit den erheblichen Schäden, die wilde Stämme verursachen, auf die Lunge niederzuschlagen. "Ein solches Szenario ist theoretisch durchaus vorstellbar", meint Pereis. "Ich würde jedoch nicht mein Leben darauf verwetten."
Die mutierten Viren von Fouchier und Kawaoka verursachen bei den Frettchen mildere Krankheitsverläufe als ihre wilden Gegenstücke. Beide Forscher räumen jedoch ein, dass ein solcher Vergleich irreführend ist, da wilde H5N1-Stämme den Tieren direkt verabreicht werden müssen, so dass es zu hohen Konzentrationen in der Lunge kommen kann. Zudem merkt Kawaoka an, dass übertragbare Stämme keine Sterblichkeitsrate von 60 Prozent aufweisen müssen, um Millionen Menschen in den Tod zu reißen: Die H1N1-Pandemie von 1918 wies nur eine Sterblichkeitsrate von 2,5 Prozent auf und tötete damit immer noch 50 Millionen Menschen.
Was könnte außerdem ein Pandemie hervorrufen?
Der Gs/Gd-Stamm ist ein so genanntes Mischvirus. Er entstand durch eine Grippeversion der geschlechtlichen Vermehrung, bei der verschiedene Viren dieselbe Zelle infizieren und dabei Gene austauschen. Wahrscheinlich enthält er Gene der Viren H6N1 und H9N2 [8]. Seitdem haben H5N1-Abkömmlinge ihre Gene hauptsächlich untereinander ausgetauscht. "H5N1 ist sexuell nicht sehr vielseitig", erklärt Capua. "Es tauscht Gene vornehmlich innerhalb der eigenen Linie aus." Aber der für die Pandemie 2009 verantwortliche H1N1-Stamm könnte H5N1 aus seiner Isolation lösen. Dieser Stamm ist selbst ein Gen-Cocktail aus den H1N1-Stämmen bei Schweinen und Geflügel und dem menschlichen H3N2-Stamm. Zudem enthält er den TRIG-Gensatz (für "Triple-reassortant Internal Gene"), der Grippeviren offenbar für eine Vermischung genetischer Informationen, die so genannte Reassortierung, empfänglicher macht. "Dieses Virus kreuzt sich mit Vorliebe", so Webster.
Das Team von Kawaoka hat gezeigt, dass die beiden Viren kompatibel sind und spontan Gene tauschen, wenn sie die gleichen Zellen infizieren [9]. Da beide Schweine infizieren können, gibt es dazu durchaus Gelegenheit. Die Virologin Stacey Schultz-Cherry vom St. Jude Children's Research Hospital hat zudem herausgefunden, dass reassortierte Viren, die HA von H5N1 und weitere Gene vom pandemischen H1N1 enthalten, sich in menschlichen Lungenzellen besser replizieren als die jeweiligen Elternstämme und dass sie nach einigen Replikationen an Virulenz gewinnen [10].
Die Virologin Wendy Barclay vom Imperial College London gibt jedoch zu bedenken, dass diese Experimente zwar die Möglichkeit einer Reassortierung zeigen, jedoch nichts über die Wahrscheinlichkeit aussagen, mit der dieser Fall eintreten könnte. "Man kann das Ergebnis erzwingen, aber ich kenne niemanden, der das Experiment unter eher natürlichen Umständen durchgeführt hat", erklärt sie. Dazu müsste man gesunde Schweine, mit dem pandemischen H1N1 infizierte sowie mit H5N1 infiziertes Geflügel gemeinsam beherbergen. "Werden sie mit beiden Viren infiziert, und vermischen sich die Viren?" fragt Barclay. "Das ist noch unbekannt, wäre aber ziemlich wichtig zu wissen."
Eine H5N1-H1N1-Reassortierung hätte den Vorteil, dass viele Menschen bereits mit H1N1 infiziert wurden und damit eine gewisse Immunität besäßen. Nur wenige Menschen sind jedoch bisher mit einem der Grippeviren, die unter Vögeln übertragen werden, in Berührung gekommen. "Die größte Sorge besteht meiner Meinung nach darin, dass ein Geflügelvirus sich irgendwie zu uns herüber kreuzen könnte", so Farrar. Auf Grund der Schwere der bekannten Infektionen steht H5N1 ganz oben auf der Problemliste, aber andere Subtypen könnten früher pandemisch werden.
"H9N2 wäre ein ebenso plausibler Kandidat für eine Pandemie", erklärt Peiris. Es bleibt weit gehend unbemerkt, ist jedoch in asiatischem Geflügel untergetaucht, hat bereits gelegentlich Erkrankungen bei Menschen ausgelöst und kann sich mit der saisonalen Grippe kreuzen. Einige Stämme weisen bereits Mutationen auf, die eine leichtere Übertragbarkeit auf Säugetiere begünstigen sollen. H7N7 ist ähnlich weit verbreitet und wird ebenfalls kaum gemeldet. 2003 brach es in den Niederlanden aus, infizierte 89 Menschen und tötete einen Veterinär. Virologen erhoffen sich von der Entschlüsselung des Geheimnisses, das H5N1 erlaubt, sich mit tödlicher Wirkung zu verbreiten, eine bessere Einschätzungsmöglichkeit der Risiken durch andere Subtypen. "Grippe ist unberechenbar", erklärt Capua.

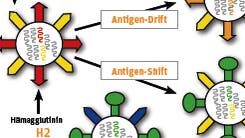

Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.