Krebsforschung: Ganz offen ambitioniert

Jay Bradner weiß, sich im Internet öffentlich Gehör zu verschaffen. Man kann ihm auf Twitter folgen oder – als einer von mittlerweile 400 000 – online seinen TEDx-Videotalk ansehen, den er im letzten Jahr in Boston, Massachusetts gehalten hat. Man kann auch ein 3-D-Strukturmodell der Substanz einsehen, die er im Labor als neuen Krebsmedikament-Prototypen gebastelt hat; oder bei ihm per E-Mail eine Probe der Verbindung ordern.
Bei Bradner, dem Mediziner und Biochemiker vom Dana-Faber Cancer Institute in Boston, hört er sich ganz leicht an, der Sieg gegen den Krebs – nur im Gedächtnis der Tumorzelle müsse man ein wenig herumspielen. „Bei all dem was Krebs so anstellt um einen Patienten umzubringen – wieso erinnert er sich da eigentlich daran, dass er ein Krebs ist?“ lautet einer dieser Fragen, die er im TEDx-Talk einem hingerissenen Publikum stellt. Die Antwort, sagt Bradner, lasse sich in der Epigenetik finden, dem Verwaltungsprogramm des Genoms.
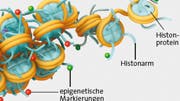
DNA agiert als basale Blaupause jeder zellulären Aktivität, und längst ist auch klar, dass DNA-Mutationen eine wichtige Rolle bei der Entstehung von Krebs spielen. Einen ebenfalls großen Einfluss auf die Identitäten von Zellen haben aber auch Modifikationen ihres Chromatins – also der Gesamtheit der Bindungs- und Verpackungsproteine der DNA. Epigenetische Instruktionen – in Form chemischer Marker, die an das Chromatin binden – regulieren dabei, wie die angesteuerten genetischen Information in den unterschiedlichen Zellen verarbeitet werden. So entscheiden sie etwa, ob eine Zelle in die Rolle einer Blut- oder Muskelzelle schlüpft.
In den vergangen zehn Jahren ist immer deutlicher geworden, dass im Fall von Krebs die epigenetische Befehlskette aus dem Ruder läuft: Wachsumsbeschleunigende Gene werden plötzlich in wie wild abgelesen, während gleichzeitig Gene abgeschaltet werden, die den Zellzyklus unter Kontrolle halten sollen. Bradner sucht nach einem als Reset-Schalter fungierenden Wirkstoff, der die Befehle zurückschreibt und das Programmgedächtnis der Zellen löscht, um ihr tödliches Wuchern so zu stoppen.
Einen der heimtückischsten Krebstreiber möchte Bradner dabei mehr als andere stoppen: das DNA-bindende Protein Myc. Myc spielt bei 70 Prozent aller Krebsfälle eine Rolle – wogegen, so die allgemein geteilte Meinung, derzeit kein Kraut gewachsen ist, weil die für die Funktion wichtigen Teile des Proteins nicht mit den typischen kleinmolekularen Substanzen attackiert werden können, die normalerweise vom Fließband der Pharmakologen rollen. Myc, meint Dash Dhanak, Chef der Krebsepigenetikabteilung bei GlaxoSmithKline in Collegeville, Pennsylvania, "ist eines der Traumangriffsziele" der Krebsforscher.
"Leute wie Jay haben unsere Grenzen ein ganzes Stück verschoben"
In diesem Licht wirkt es gewagt, dass Bradner seine Idee und ihre Früchte der Wissenschaft und Öffentlichkeit frei verfügbar zu machen sucht – eine kaum verbreitete Haltung in Zeiten des immer schärfer ausgetragenen Konkurrenzkampfes auf dem Pharmamarkt. Dessen ungeachtet hat er an Hunderte von Forscherkollegen in der Welt die Substanz verteilt, die von seiner Arbeitsgruppe entwickelt wurde – ein Molekül, das mit Myc interagiert und die epigentische Programmierung manipuliert. "Nicht eben der übliche Weg", so Bradner, "aber der richtige, wenn ich meinen Grundprinzipien treu bleiben möchte".
Der flamboyante Stil des Forschers sorgt für Getuschel bei Kritikern – wer mit seinem Werdegang vertraut ist, findet allerdings Grund zur Annahme, er habe das Format, den großen Worten auch Taten folgen zu lassen. Stuart Schreiber, der Leiter der Biochemie am Broad Institute in Cambridge, Massachusetts und Chef des früheren Postdoktoranten Bradner, meint etwa: "Jay weiß ganz genau, wie man den Schritt von der klinischen zur anwendungsbezogenen Forschung hinbekommt. Er bringt es ziemlich gut unter einen Hut, wichtige Forschungserkenntnisse zu sammeln und dabei das klinische Potenzial nicht aus dem Auge zu verlieren".
Noch als Student an der Harvard University hat Bradner 1992 einen von Schreiber angebotenen Kurs über die Chemie kleiner Moleküle und ihre Aufklärung belegt. Die dabei erlernten Methoden wollte Bradner nach seinem Abschluss in der Krebsforschung anwenden. Er ging an die Pritzker School of Medicine an der University of Chicago.
Marker des Todes
1999 kam er dann zurück nach Massachusetts, um am Brigham and Women's Hospital in Boston eine Klinikstelle anzutreten, bis er schließlich 2004 in der Arbeitsgruppe von Schreiber als Postdoc anfing. Das Team arbeitete dort damals an chemischen Komponenten, die Chromatin remodulieren und so die epigenetische Kontrolle der Genexpression übersteuern können. Im Wesentlichen unterscheidet man bei solchen Kontrollsystemen drei Typen von Eiweißen: Schreib-, Lese- und Löschproteine. Die "Schreiber" verändern dabei chemische Marker wie Methylgruppen (auf der DNA) oder Azetylgruppen (auf den Histonen, in der die Erbsubstanz verpackt ist); "Leser" binden an diese Marker und beeinflussen so die Expression, und "Löscher" entfernen die Marker. Die chemischen Markierungen selbst fungieren dabei als Langzeit-Befehlsgeber, die auch über eine Teilung der Zellen hinweg ein Gedächtnis bewahren, so dass zum Beispiel Hautzellen immer nur Hautzellen hervorbringen. Das Forschungsgebiet Epigenetik hatte nun bereits eine steile Karriere hingelegt.
Schreibers Team war damals schon seit längerem auf der Suche nach Histon-Deazetylasen (HDACs) – also Löschproteinen, die Azetylgruppen von Histonen entfernen. Einige Bereiche des Chromatins von Krebszellen wiesen bekanntermaßen weniger Azetylgruppen auf als normale Zellen; zudem beschleunigt sich die Azetylierung unter dem Einfluß von HDAC-Inhibitoren. Zwei dieser Inhibitoren (die Wirkstoffe Vorinostat und Romidepsin) waren 2006 von der US-Gesundheitsbehörde als Medikament gegen eine seltene Form von Hautkrebs, dem kutanen T-Zell-Lymphom, zugelassen worden. Krebsforscher erhofften sich schon damals einiges von den Medikamenten – auch wenn sie durchaus toxisch wirken können, weil sie viele unterschiedliche Varianten von HDACs in entarteten wie gesunden Zellen blockieren. Versuche, mit ihnen andere Krebssorten zu behandeln, verlief oft enttäuschend.
Einen derartigen Fehlschlag mit HDAC-Inhibitoren hat Bradner 2008, kurz nachdem er sein eigenes Labor aufgemacht hat, selbst hinnehmen müssen. Damals hatte der Pathologe Chris French vom Brigham and Women's Hospital Bradner zu einem Fall konsultiert: Er hatte einen zehnjährigen Jungen gegen eine seltene, aggressive und typischerweise innerhalb eines Jahres nach der Diagnose tödliche NUC-Mutation-Krebsvariante (NMC) behandelt. French, ein Experte für diese Krebsvariante, stellte seine Diagnose nach einer Brust-OP, bei der die Chirurgen einen baseballgroßen Tumor im Herzen des Patienten entdeckt hatten. Eine chemotherapeutische Behandlung stand außer Frage, weil sie die Erholung nach der OP zu stark beeinträchtigt hätte – und so diskutierten Bradner und French über Alternativen.
French hatte 2003 eine Fusion zweier Gene als Ursache der NMC ausgemacht: BRD4, ein "Lese-Protein" fusioniert mit dem damals noch unbekannten NUT [1]. Das mutierte Proteinprodukt NUT-BRD4 – offenbar auch ein "Leseprotein" – sorgte für eine unkontrollierte Genexpression, zerstörte die Identitäten der Zellen und ließ sie schließlich entarten. Zu dieser Zeit standen noch keine Leseprotein-Inhibitoren zur Verfügung, French und Bradner war aber bekannt, dass Vorinostat die Histon-Azetylierung verstärkt. Vielleicht, so ihre Idee, könnte man NUT-BRD4 durch eine allerorts erhöhte Azetylierung derart mit dem Auslesen beschäftigen, dass es die Gen-Regionen vernachlässigt, bei denen seine Aktionen Krebs verursachen: "Die chemische Variante der Nebelkerze", beschreibt Bradner das Konzept.
Die Idee stand eigentlich auf tönernen Füßen, French und Bradner hielten einen Versuch angesichts der Notlage aber für gerechtfertigt: sie testeten den Wirkstoff an extrahierten Krebszellen des Jungen. Und tatsächlich: Die Tumorlinie schien ihre Marschrichtung zu ändern, aus runden, sich rasch teilenden Zellen wurden flache, hautzellähnliche. Mit gestärkter Zuversicht behandelten sie nun das erkrankte Kind. Nach fünf Wochen schien der Tumor tatsächlich zu reagieren, insgesamt aber erwiesen sich die toxischen Nebenwirkungen als zu stark. Der Junge "brauchte vier Stunden, um drei Tabletten der Medikation zu schlucken, weil er sich ständig erbrechen musste", erinnert sich French. Die Behandlung musste abgebrochen werden; wenig später starb das Kind.
Bradner hat diesen Fall lange mit sich herumgetragen und daraus gelernt – vor allem über BRD4, einem zuvor kaum untersuchten Protein, das nun plötzlich als patenter Krebsauslöser erschien. Verschiedene Forschungsansätze verstärkten den Eindruck, dass BRD4 womöglich an der Expression von Myc beteiligt sein könnte – einem Angriffsziel, von dem viele Forscher längst Abschied genommen hatten. Vielleicht, so Bradner, könnte man das berüchtigte Schreckgespenst der Krebsforschung zähmen, indem man BRD4 entschärft?
Dann, 2009, stolperte Bradner über ein vom japanischen Pharmakonzern Mitsubishi Tanabe aus Osaka eingebrachtes Patent. Es schützte eine benzodiazepinbasierte Substanz, die BRD4 hemmt, indem es seine Bromodomäne blockiert – also den Proteinabschnitt, der die Azetylgruppen auf den Histonen erkennt. Marktübliche Benzodiazepine – etwa das angstlösende Alprazolam (der Wirkstoff in Monopräparaten wie Xanax) – interagieren kaum mit den Bromodomänen. "Man hätte jeden Patienten längst ins Koma versetzt, bevor BRD4 gehemmt wäre", erläutert Bradner. Also machte er sich auf die Suche nach ähnlich aufgebauten, dabei aber treffsichereren Molekülen. Jun Qi, einer von Bradners Kollegen, hat auf der Suche nach viel versprechenden Kandidaten über 400 Benzodiazepine synthetisiert.
Bis die Gruppe Ende 2009 dann Erfolg meldete: "JQ1" (benannt nach Qi) schlüpft in eine der Rillen des BRD4-Proteins und verhindert so, dass es an Azetylgruppen auf Histonen bindet und Gene anschaltet. JQ1 könnte somit das Werkzeug sein, das die von BRD4 aktivierten Gene aufdeckt – und, das hoffen die Forscher zumindest, sie darüber informiert, ob eines dieser Gene tatsächlich Krebs auslöst.
Hoffnung aus der Forschung
März 2010 lernte Bradner einen weiteren von Frenchs NMC-Patienten kennen; weder eine Chemotherapie noch das Medikament Romidepsin haben dem 29-jährigen Feuerwehrmann zuvor helfen können. Bradner hatte seine Einwilligung eingeholt, an seinen Zellen forschen zu dürfen und das Versprechen gegeben, so einer möglichen wirksamen Therapie schneller auf die Spur kommen zu können. Im Juli starb der Patient – an seinen Zellen aber konnte JQ1 nun erstmals getestet werden. Und wirklich stoppte die Substanz die Teilungen der Krebszellen und verwandelte sie in nicht entartete Zellen. Das funktioniert sowohl in Zellkulturen wie auch im Körper von Mäusen [2].
Jahre vergehen üblicherweise, bis hoffnungsvolle Medikamentenkandidaten tatsächlich in der Klinik anwendungsreif sind. Wäre JQ1 von einer Pharmafirma entdeckt worden, dann hätte sich nun wahrscheinlich eine Phase angeschlossen, in der ein kleines Team dem Molekül noch einigen Feinschliff verpasst hätte, um es zum Medikament weiterzuentwickeln – alles wahrscheinlich unter strikter Geheimhaltung. Bradner entschied dagegen, die Substanz sei schnellstmöglich zur Anwendungsreife zu bringen, indem er sie offen, und unter der Mitwirkung möglichst vieler Beteiligter weiter erforscht. So ist seit Januar 2011 JQ1 an 250 Labore in der ganzen Welt verschickt worden. Mindestens zehn Studien über die Substanz sind mittlerweile in einflussreichen Wissenschaftsjournals veröffentlicht worden.
Eine dieser Studien – einer Kooperationsarbeit von Bradner mit dem Tumorbiologen Constantine Mitsiades vom Dana-Faber Institute, belegte auch erneut den Zusammenhang zwischen BRD4 und Myc [3]. Mitsiades hatte schon herausgefunden, dass die Zellen multipler Melanome Myc und BRD4 in großen Mengen exprimieren – ein Wissenspuzzlestück, das ihm allerdings nicht weiterhalf, weil ihm eine Komponente gefehlt hatte, die gegen die beiden Moleküle eingesetzt werden konnte. Nun fand er heraus, dass Bradners JQ1 die Expression von Myc und allen seinen Zielgenen reduziert und die Teilung von Myelomzellen in Mäusen stoppt.
Chris Vakoc, ein Krebsbiologe vom Cold Spring Harbor Laboratory in New York, hatte die Rolle von BRD4 bei Leukämie erforscht, als er zum ersten Mal von JQ1 hörte – und sofort zum Telefonhörer griff, um Bradner anzurufen. "Am nächsten Tag hatte er uns massenhaft JQ1 geschickt", erinnert sich Vakoc, der damit einiges anzufangen wusste: JQ1 stoppte in seinen Experimenten die Krebszellproliferation in Leukämiemäusen und verlängerte ihre Überlebensdauer deutlich [4]. In weiteren Studien wurde untersucht, welche Rolle JQ1 bei Infektionskrankheiten spielt – etwa den vom Epstein-Barr- oder dem HI-Virus ausgelösten Erkrankungen [5, 6].
"Was da nach meinem öffentlichen Ansatz weltweit in einem Jahr an JQ1-Forschung geleistet worden ist, hätte ich in meinem Labor in 20 Jahren nicht erledigt bekommen", meint Bradner. Mit Hilfe einer Spritze von 15 Millionen US-Dollar Investitionskapital der HealthCare Ventures in Cambridge konnte Bradner das Biotech-Startup Tensha Therpeutics ins Leben rufen, das sich nun auf die Inhibition der Bromodomäne spezialisiert. Ebenfalls in Cambridge screent die junge Firma jetzt JQ1-Derivate um herauszufinden, welche die geringsten Nebenwirkungen haben – einer der wichtigsten Schritte bevor ein Medikament ausgereift ist.
Tatenlos abzuwarten ist allerdings keine Stärke von Bradner: Er sucht unterdessen weiter nach bereits in der Entwicklungspipeline befindlichen Wirkstoffen, mit denen NMC vielleicht effektiv bekämpft werden könnten. So hatten GlaxoSmithKline-Forscher zum Beispiel 2010 einen Inhibitor veröffentlicht, der sich gegen BRD4 und verwandte Moleküle richtet und Blutvergiftungen verhindern soll [7]. Eine dieser Substanzen wollte Bradner nun am Dana-Faber Institute erforschen – er holte die Erlaubnis der GSK ein (die, so Dhanak, seit Frenchs erster NUT-RRD4-Studie 2003 unverdrossen an BRD4-Inhibitoren geforscht hatte) und bekam sie.
Im März begann der erste Test: Die Dana-Faber-Onkologen brachten den Inhibitor GSK525762 in Stellung, um einem 23-Jährigen Ingenieurstudenten mit NMC zu helfen. Der Patient starb allerdings schon drei Wochen nach Beginn der Therapie. Wahrscheinlich war die Dosis zu niedrig, vermutet French, und womöglich würde eine Kombinationstherapie von HDAC-Inhibitoren mit anderen epigenetischen Medikamenten erfolgreicher wirken. Solche Kombinationen könnte die GSK in der Tat bald beginnen zu testen, verrät Dhanak.
Es wird dauern, bis NMC-Experimente in der Klinik Ergebnisse abwerfen: Die Erkrankung ist sehr aggressiv und zugleich selten; nur 90 Fälle sind in den letzten zehn Jahren diagnostiziert worden. Bradner und seine Mitstreiter haben daher 2011 ein Registrierungsprogramm ins Leben gerufen, mit dessen Hilfe die Aufmerksamkeit für NMC erhöht und es Betroffenen erleichtert werden soll, sich freiwillig für Versuche zu melden. Dies läuft gut an: "Wir hatten erst Sorge, genug freiwillige Patienten aufzutreiben; tatsächlich finden Patienten im Zeitalter der sozialen Medien nun aber uns", so Bradner.
Besser Heilen
Bradners Optimismus wird in der Forschergemeinde nicht einhellig geteilt. "Epigenetik ist schon das große neue Ding; aber wenn man genau hinschaut, stochert man da grad erst ein wenig drin herum und entdeckt dann natürlich auch ein paar spannende Dinge", findet etwa Gerard Evan, ein Tumorbiologe, der an der University of Cambridge in England epigenetische Signalketten erforscht. Die Epigenetik beeinflusst enorm viele Zellfunktionen, und die Forschergemeinde fängt gerade erst an zu verstehen, wie sie das Zellgedächtnis verändert.
Aber egal wo die Reise endet: Bradners offener Forschungsansatz weckt an einigen Stellen Optimismus. Etwa bei Dhanak: "Leute wie Jay haben unsere Grenzen ein ganzes Stück geweitet".
Bradners größter Wunsch, sagt er, bleibe derweil das Versprechen einzulösen, dass er dem an NMC verstorbenen Feuerwehrmann gegeben hatte: "Seine Spende der seltenen Tumorzelllinie; zugesagt, nachdem alle Therapiemöglichkeiten erschöpft waren – das werde ich so schnell nicht vergessen". Und falls die Inhibition der Bromodomänen scheitere, werde er seinen offenen Forschungsansatz eben mit einem anderen Angriffsziel wiederholen. "Irgendwie glaube ich immer fester daran, dass krebsleidenden Patienten gerade so am besten geholfen werden kann – und dass es dabei ziemlich egal ist, ob der Wirkstoff dann von uns oder von anderen Forschern stammt".
Der Orginalartikel erschien unter dem Titel "Open Ambition" in Nature 488, S. 148–150, 2012





Schreiben Sie uns!
Beitrag schreiben