Infektionskrankheiten: Versteckwechsel
Das Leben ist kompliziert, zum Beispiel da, wo kleine tödliche Bakterien die Zellen großer Organismen manipulieren, um deren Abwehrsystem auszuhebeln und selbst zu überleben. Will man solche Keime bekämpfen, sollte man genau wissen, was man tut. Das klappt offenbar nicht immer.
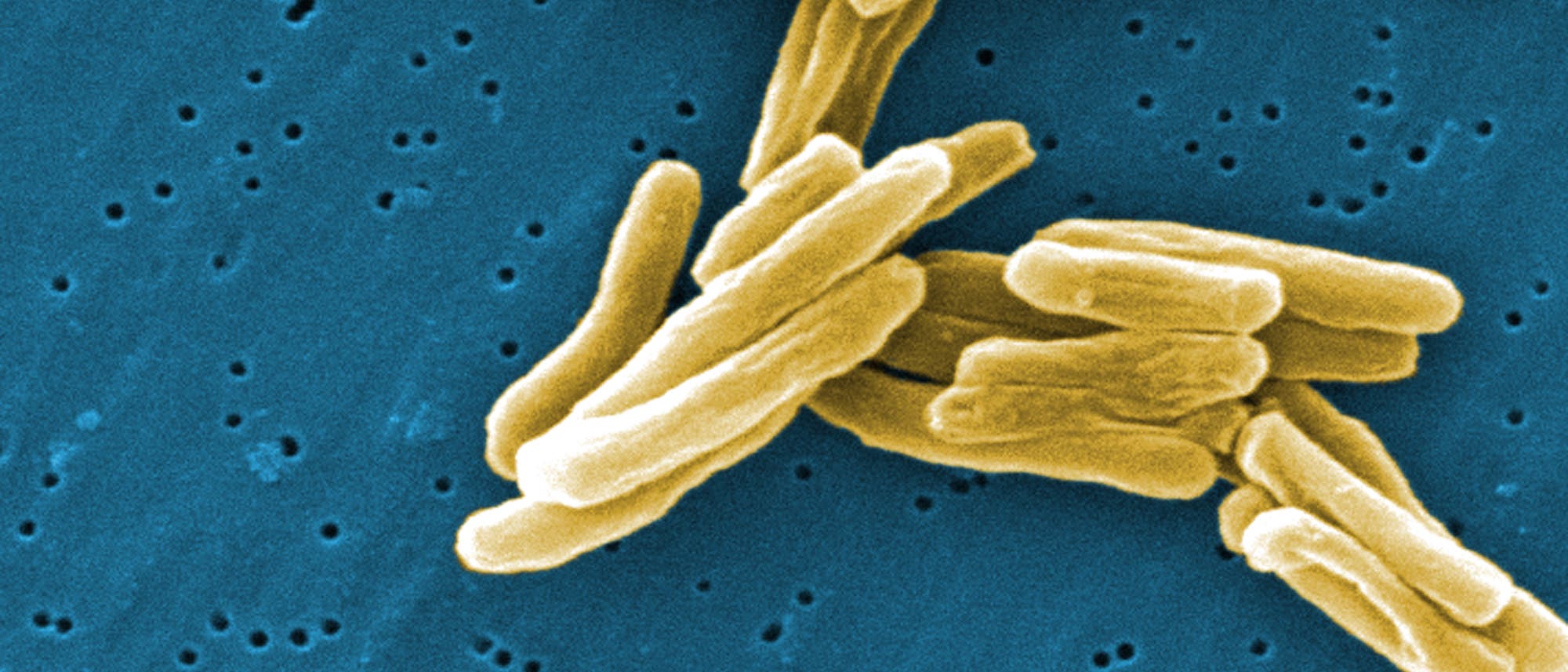
© CDC / Janice Haney Carr (Ausschnitt)
Tuberkulose ist altbekannt und allzu oft tödlich: Noch immer ist ein Drittel der Weltbevölkerung mit dem Erreger Mycobacterium tuberculosis infiziert, jährlich erkranken vielleicht acht Millionen Menschen neu. Und auch wenn niemand ganz genaue Zahlen kennt, weil die Krankheit wegen ihrer eher unspezifischen Symptome häufig nicht exakt diagnostiziert wird: Wohl deutlich mehr als zwei Millionen Menschen, vor allem aus ärmeren Regionen der Erde, sterben pro Jahr an der Infektion.
Und das alles, obwohl eine wirksame Behandlung mit Antibiotika im Prinzip existiert – nur muss sie kontrolliert mit mehreren Medikamenten über einen längeren Zeitraum eingehalten werden, was oft nicht möglich ist. Parallel suchen Forscher daher schon seit langem nach einer Möglichkeit, die Infektionen mit einer Impfung schon im Vorfeld zu verhindern. Dabei haben sie viel gelernt – vor allem über die sehr effizienten Mittel und Wege des TB-Bakteriums, sich körpereigenen Abwehrmaßnahmen erfolgreich zu entziehen, die durch eine Impfung angestachelt werden.
Ein Trick des Bakteriums: Es versteckt es sich im Inneren jener Abwehrzellen, die ihm eigentlich gefährlich werden sollten, den Fresszellen oder Makrophagen. Hier streuen die Keime Sand ins Alarmgetriebe des Immunsystems, indem sie die Zellen an ihrem Job hindern: dem Rest der Körperabwehr die Anwesenheit der Tuberkel-Bazillen mitteilen. Um das zu auszuschalten, stoppt M. tuberculosis den Bau von MHC-Molekülen, die zusammen mit Bruchstücken von Krankheitserregern sonst auf der Fresszell-Außenseite den Körperabwehr-Nachschub der spezifischen T-Zellen rekrutiert.
Auch der Aufenthaltsort der Bakterien in den Abwehrzellen ist genau untersucht: Wie Forscher schon früh verblüfft feststellten, gehen die Keime schnurstracks dahin, wo es ihnen eigentlich sehr weh tun müsste – in die Phagosomen. Diese kleinen Bläschen zerlegen im Hauptberuf eigentlich sämtliche von den Fresszellen verschluckten Abfälle und Eindringlinge – nachdem sie mit den so genannten Lysosomen verschmolzen sind, mit denen eine totalzerlegende Lösung antransportiert wird. M. tuberculosis fühlt sich gerade in den Phagosomen nichtsdestotrotz wohl, gedeiht und vermehrt sich.
Nachdem Biologen und Medizinern diesen Versteck-Kniff erkannt hatten, war die Hoffnung groß, bald Waffen gegen die Anti-Immunwaffe der Bakterien zu finden – alle gezielt gerichtet gegen die in den Phagosomen der Fresszellen hausenden Erreger. Irgendwie hat das aber in der Praxis nie so gut funktioniert wie gehofft und vorher auch glänzend mit Laborstämmen und Zellkulturen bewiesen. Peter Peters von Krebsforschungsinstitut der Niederlande und seine Kollegen haben nun einen möglichen Grund für das Scheitern der viel versprechenden Impfansätze entdeckt.
Die Forscher hatten noch einmal ganz von vorne angefangen und mit einem etwas lebensnäheren Zellmodell und verbesserter Mikroskoptechnik bis zu sieben Tage lang genau hingeschaut, wann und wo sich M. tuberculosis und sein Vetter M. leprae in einer Wirtszelle aufhalten. Dabei fanden die Forscher die Bakterien zunächst, wie gehabt und erwartet, in den Phagosomen. Dann aber stellten sie verblüfft fest, dass die Zellbläschen schon recht bald mit Lysosomen verschmolzen – man hatte eigentlich stets gedacht, dass die Keime im Inneren genau das zu verhindern wissen, um ihren phagosomalen Aufenthaltsort vom Lysosomeninhalt sauber zu halten.
Ganz offenbar ist mit der Ankunft der Lysosomen tatsächlich auch die Zeit der Tuberkel-Bakterien im Phagosom zu Ende, ermittelten die Wissenschaftler weiter: Nur zwei Tage nach dem Eindringen in die Zelle verlassen die Bakterien – und zwar sowohl M. tuberculusis als auch M. leprae – das zunehmend ungemütliche Zellbläschen und begeben sich ins Zytosol der Zellen, ganz so, wie Bakteriologen es etwa von Lebensmittelvergiftern wie den Listeria-Keimen kennen.
Offenbar also finden sich in den Zellen infizierter Menschen Tuberkulose-Keime demnach gar nicht dort, wo Impfstoffentwickler sie vermutet hatten – was damit zusammenhängen könnte, dass viele Wissenschaftler zuvor die Wanderung der Bakterien nur höchstens 48 Stunden lang beobachtet hatten. Zudem arbeiten auch heute noch wohl viele Tuberkulose-Forscher mit einem falschen Modellorganismus, fürchten Peters und Kollegen. Denn fatalerweise unterscheiden sich die Wildform des Keims ganz wesentlich von Laborstämmen wie "M. bovis BCG", die Forscher weltweit zur Vakzinentwicklung einsetzen: Dieser Stamm, zeigen die neuen Ergebnisse, verbleibt nämlich tatsächlich auch länger als zwei Tage in den Phagosomen.
Impfstoffe, die gezielt für eine solche Situation entwickelt wurden, treffen in der Realität demnach wohl häufig gar nicht die virulenten Tuberkulose-Erreger in infizierten Menschen, auf die sie gezielt hatten. Eine einleuchtende Erklärung für einen klassischen Fall von leider daneben: "Neue, effiziente Impfstoffe", meint Peters nachvollziehbar, "sollten besser mit Stämmen entwickelt werden, die die Zytosol-Wanderung virulenter Stämme nachahmen."
Und das alles, obwohl eine wirksame Behandlung mit Antibiotika im Prinzip existiert – nur muss sie kontrolliert mit mehreren Medikamenten über einen längeren Zeitraum eingehalten werden, was oft nicht möglich ist. Parallel suchen Forscher daher schon seit langem nach einer Möglichkeit, die Infektionen mit einer Impfung schon im Vorfeld zu verhindern. Dabei haben sie viel gelernt – vor allem über die sehr effizienten Mittel und Wege des TB-Bakteriums, sich körpereigenen Abwehrmaßnahmen erfolgreich zu entziehen, die durch eine Impfung angestachelt werden.
Ein Trick des Bakteriums: Es versteckt es sich im Inneren jener Abwehrzellen, die ihm eigentlich gefährlich werden sollten, den Fresszellen oder Makrophagen. Hier streuen die Keime Sand ins Alarmgetriebe des Immunsystems, indem sie die Zellen an ihrem Job hindern: dem Rest der Körperabwehr die Anwesenheit der Tuberkel-Bazillen mitteilen. Um das zu auszuschalten, stoppt M. tuberculosis den Bau von MHC-Molekülen, die zusammen mit Bruchstücken von Krankheitserregern sonst auf der Fresszell-Außenseite den Körperabwehr-Nachschub der spezifischen T-Zellen rekrutiert.
Auch der Aufenthaltsort der Bakterien in den Abwehrzellen ist genau untersucht: Wie Forscher schon früh verblüfft feststellten, gehen die Keime schnurstracks dahin, wo es ihnen eigentlich sehr weh tun müsste – in die Phagosomen. Diese kleinen Bläschen zerlegen im Hauptberuf eigentlich sämtliche von den Fresszellen verschluckten Abfälle und Eindringlinge – nachdem sie mit den so genannten Lysosomen verschmolzen sind, mit denen eine totalzerlegende Lösung antransportiert wird. M. tuberculosis fühlt sich gerade in den Phagosomen nichtsdestotrotz wohl, gedeiht und vermehrt sich.
Nachdem Biologen und Medizinern diesen Versteck-Kniff erkannt hatten, war die Hoffnung groß, bald Waffen gegen die Anti-Immunwaffe der Bakterien zu finden – alle gezielt gerichtet gegen die in den Phagosomen der Fresszellen hausenden Erreger. Irgendwie hat das aber in der Praxis nie so gut funktioniert wie gehofft und vorher auch glänzend mit Laborstämmen und Zellkulturen bewiesen. Peter Peters von Krebsforschungsinstitut der Niederlande und seine Kollegen haben nun einen möglichen Grund für das Scheitern der viel versprechenden Impfansätze entdeckt.
Die Forscher hatten noch einmal ganz von vorne angefangen und mit einem etwas lebensnäheren Zellmodell und verbesserter Mikroskoptechnik bis zu sieben Tage lang genau hingeschaut, wann und wo sich M. tuberculosis und sein Vetter M. leprae in einer Wirtszelle aufhalten. Dabei fanden die Forscher die Bakterien zunächst, wie gehabt und erwartet, in den Phagosomen. Dann aber stellten sie verblüfft fest, dass die Zellbläschen schon recht bald mit Lysosomen verschmolzen – man hatte eigentlich stets gedacht, dass die Keime im Inneren genau das zu verhindern wissen, um ihren phagosomalen Aufenthaltsort vom Lysosomeninhalt sauber zu halten.
Ganz offenbar ist mit der Ankunft der Lysosomen tatsächlich auch die Zeit der Tuberkel-Bakterien im Phagosom zu Ende, ermittelten die Wissenschaftler weiter: Nur zwei Tage nach dem Eindringen in die Zelle verlassen die Bakterien – und zwar sowohl M. tuberculusis als auch M. leprae – das zunehmend ungemütliche Zellbläschen und begeben sich ins Zytosol der Zellen, ganz so, wie Bakteriologen es etwa von Lebensmittelvergiftern wie den Listeria-Keimen kennen.
Offenbar also finden sich in den Zellen infizierter Menschen Tuberkulose-Keime demnach gar nicht dort, wo Impfstoffentwickler sie vermutet hatten – was damit zusammenhängen könnte, dass viele Wissenschaftler zuvor die Wanderung der Bakterien nur höchstens 48 Stunden lang beobachtet hatten. Zudem arbeiten auch heute noch wohl viele Tuberkulose-Forscher mit einem falschen Modellorganismus, fürchten Peters und Kollegen. Denn fatalerweise unterscheiden sich die Wildform des Keims ganz wesentlich von Laborstämmen wie "M. bovis BCG", die Forscher weltweit zur Vakzinentwicklung einsetzen: Dieser Stamm, zeigen die neuen Ergebnisse, verbleibt nämlich tatsächlich auch länger als zwei Tage in den Phagosomen.
Impfstoffe, die gezielt für eine solche Situation entwickelt wurden, treffen in der Realität demnach wohl häufig gar nicht die virulenten Tuberkulose-Erreger in infizierten Menschen, auf die sie gezielt hatten. Eine einleuchtende Erklärung für einen klassischen Fall von leider daneben: "Neue, effiziente Impfstoffe", meint Peters nachvollziehbar, "sollten besser mit Stämmen entwickelt werden, die die Zytosol-Wanderung virulenter Stämme nachahmen."

Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.