Lexikon der Biologie: Natriumkanäle
Natriumkanäle, Natriumionenkanäle, Na+-Kanäle, Ionenkanäle, die überwiegend spannungsabhängig aktiviert werden (spannungsgesteuerte Ionenkanäle) und für Natrium permeabel sind. Bei einer Depolarisation der Membran erregbarer Zellen (Nervenzellen, Muskelzellen [Muskeln] und neurosekretorische Zellen) kommt es zu einer vorübergehenden Kanalöffnung, bei der Na+-Ionen entlang ihres Konzentrations-Gradienten in die Zelle einströmen (Membranpotential; ä vgl. Abb. 1 und ä vgl. Abb. 2 ). Auf die Aktivierung der Kanäle erfolgt im Bereich weniger Millisekunden die Inaktivierung. Nach der Inaktivierung durchläuft ein Kanal eine Refraktärzeit, in der er nicht von neuem aktiviert werden kann: Erst nach dem Ende der Depolarisation mit Übergang vom inaktivierten in den geschlossenen Zustand (closed state) können Na+-Kanäle wieder geöffnet werden. Überschreitet die Depolarisation in diesen Zellen ein bestimmtes Schwellenpotential, kommt es zur Ausbildung eines Aktionspotentials, dessen Kinetik durch die Interaktion der Inaktivierung der Na+-Kanäle und Aktivierung spannungsabhängiger Kaliumkanäle bestimmt wird. Auch in nicht erregbaren Gliazellen wurden Na+-Kanäle beschrieben. – Es gibt zahlreiche Pharmaka und Toxine, die Na+-Kanäle beinflussen können. Sie lassen sich in 2 Klassen einteilen: in Kanal blockierende Substanzen (Na+-Kanal-Antagonisten), welche die Na+-Leitfähigkeit der Zellmembran und somit ihre elektrische Erregbarkeit reduzieren, und solche, welche die Na+-Leitfähigkeit der Zellmembran erhöhen, indem sie entweder Na+-Kanäle direkt aktivieren oder ihre Inaktivierung verlangsamen (Na+-Kanal-Agonisten). Zu letzteren gehören z.B. das lipidlösliche AlkaloidAconitin (Aconitumalkaloide) aus dem Blauen Eisenhut und das Batrachotoxin eines kolumbianischen Pfeilgiftfrosches (LD50 2 μg/kg Körpergewicht Maus). Zu den selektivsten Kanalblockern (Antagonisten) gehört das Tetrodotoxin (TTX, ein Gift der Kugelfische). Der jeweilige Rezeptor für die verschiedenen Substanzen am Na+-Kanal ist verschieden. – Mehrere Gene für Na+-Kanal-Untereinheiten sind bekannt, und alternatives Spleißen kann zusätzlich zu einer Vielzahl möglicher Kanalproteine führen. Neben den biophysikalischen und molekularbiologischen Eigenschaften bildet die Sensitivität für das oben erwähnte Tetrodotoxin ein Hauptunterscheidungskriterium. TTX-sensitive Na+-Kanäle werden bereits bei Konzentrationen unter 1 μmol/l blockiert, während TTX-resistente Na+-Kanäle erst bei deutlich höheren Konzentrationen inaktiviert werden. Daneben wurden auch spannungsunabhängige Na+-Kanäle beschrieben. Das bekannteste Beispiel ist der Amilorid-sensitive Na+-Kanal (Amilorid) in Epithelzellen. Na+-Kanäle bilden die Zielstruktur von Pharmaka (Analgetika, Anästhetika, Antiarrhythmika, Antiepileptika, Lokalanästhetika).
W.N.
Natriumkanäle
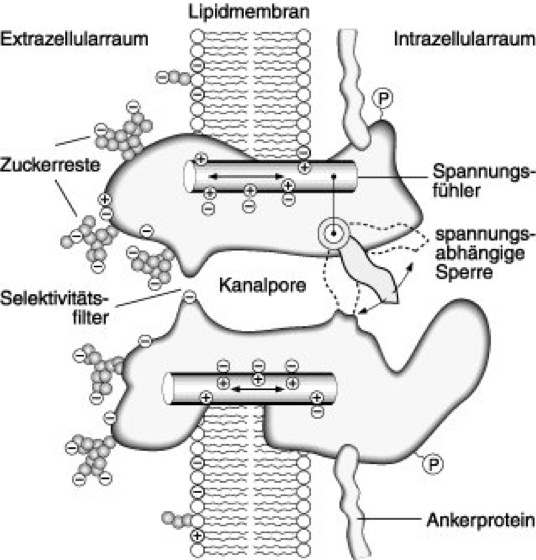
Abb. 1: Arbeitsmodell eines spannungsabhängigen Natriumkanals. Der Kanal ist als transmembranäres Makromolekül, mit der wäßrigen Kanalpore in der Mitte, dargestellt. Die extrazelluläre Seite des Proteins ist glykosyliert. Über Ankerproteine ist der Kanal mit dem Cytoskelett verbunden. Die Kanalpore ist über den größten Teil ihrer Ausdehnung weiter als der Natriumionendurchmesser, verengt sich aber in einem kurzen Abschnitt zum sog. Selektivitätsfilter, der vermutlich nur einige Atomradien weit ist. Die Weite des Filters sowie negativ geladene Gruppen in diesem Bereich bedingen die relative Selektivität für Na+. Öffnen und Schließen des Kanals (Gating) erfordert Konformationsänderungen der Pore, durch die eine Sperre (Gate) aus einer die Pore blockierenden Position wegbewegt wird. Die Bewegung dieser Sperre wird durch einen Spannungsfühler kontrolliert. Ändert sich das elektrische Feld der Zellmembran bei Depolarisationen, kommt es zur Verschiebung geladener Gruppen des Spannungssensors; die Sperre wird geöffnet, Na+-Ionen können den Kanal passieren. Ähnliche Strukturen, wie hier für spannungsabhängige Na+-Kanäle gezeigt, werden auch für spannungsabhängige Ca2+-, K+- und Cl–-Kanäle angenommen.
Natriumkanäle
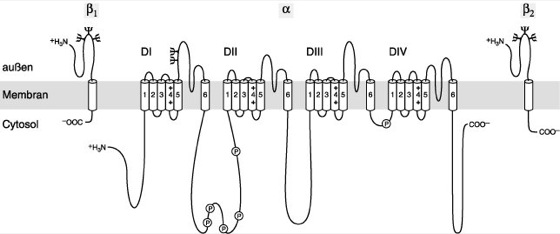
Abb. 2: Theoretische transmembranäre Struktur des spannungsabhängigen Natriumkanals. Der am besten untersuchte Na+-Kanal aus dem Hirn der Ratte ist aus 1 α- und 2 β-Untereinheiten aufgebaut. Auf der dem Extrazellularraum zugewandten Kanalseite befinden sich Glykosylierungsstellen. Die α-Untereinheit besteht aus einem Protein mit 4 homologen Domänen (DI–DIV), die sich ringförmig zusammenlagern und eine Pore bilden. Jede dieser Domänen weist 6 α-helikale transmembranäre Abschnitte (S1–S6) auf. Zielgerichtete Mutagenese von Aminosäuren der α-Untereinheit ermöglicht die Aufklärung der Funktion einzelner Abschnitte. Die teilweise in die Membran zurückkehrenden Schleifen zwischen S5 und 6 (P-[Poren-]Region) bilden den Eingangsbereich der Kanalpore und den Selektivitätsfilter, positiv geladene Aminosäuren (Arginin oder Lysin) in S4 den Spannungssensor (gating charge). Er reagiert auf Änderungen des elektrischen Feldes über der Zellmembran mit einer Konformationsänderung und initiiert so die Kanalöffnung. Die intrazelluläre Schleife zwischen DIII und DIV ist essentiell für die rasche Inaktivierung der Kanäle. Nach Aktivierung verlegt sie die offene Pore und blockiert so den Natriumionenfluß. Der Aufbau der α-Untereinheit ist analog den spannungsabhängigen Calciumkanälen; spannungsabhängige Kaliumkanäle sind ebenfalls sehr ähnlich strukturiert. In Xenopus-Oocyten führt die alleinige Expression der α-Untereinheit zur Bildung funktionsfähiger Na+-Kanäle, deren Aktivierungs- und Inaktivierungskinetik jedoch stark verlangsamt und deren Einzelkanalleitfähigkeit um ca. 60% geringer sind als die normaler Kanäle. Erst eine Co-Expression mit der β1-Untereinheit führt zu einer Kinetik und Einzelkanalamplitude nativer Kanäle. Hierin scheint die Bedeutung der β1-Untereinheit zu liegen. Für die über Disulfidbrücken kovalent gebundene β2-Untereinheit wird eine Rolle bei der Genese sowie bei Transport und Einbau der Na+-Kanäle in die Zellmembran postuliert.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.