Antisense-Antibiotika: Zielgenaue Bakterienkiller gegen Resistenzen
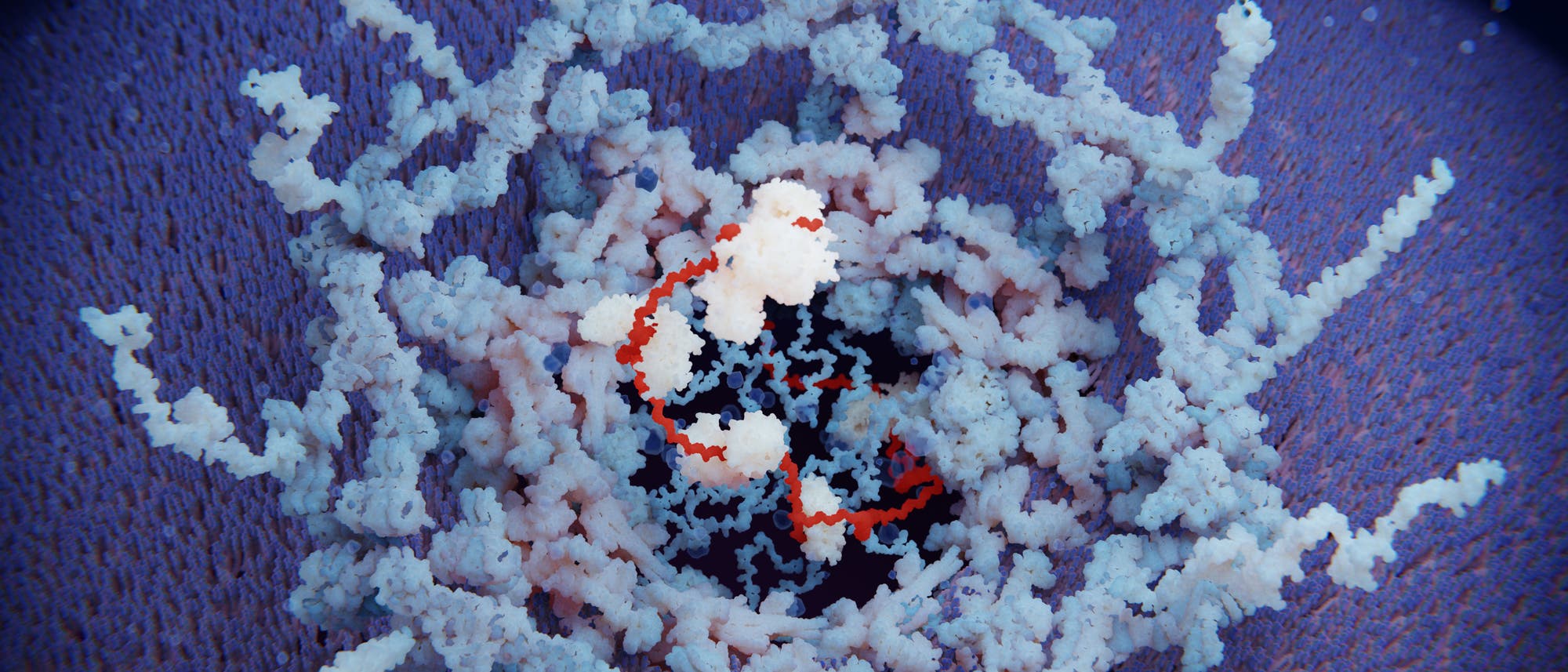
Heutige Antibiotika retten Leben, doch sie haben zwei entscheidende Probleme. Zum einen sind sie Massenvernichtungswaffen und schlagen eine Schneise der Zerstörung durch das Mikrobiom. Nützliche und hilfreiche Bakterien gehen zu Grunde, mit Folgen für den Menschen – fast jeder Dritte, der sie einnimmt, bekommt Durchfall. Bei Kindern stehen Antibiotika im Verdacht, etwa das Risiko für das spätere Auftreten von Allergien, Asthma und Schuppenflechte zu erhöhen. Noch dramatischer ist, dass immer mehr Bakterien gegen die Stoffe resistent werden.
Doch man kann diese beiden Probleme umgehen – und das mit einer einzelnen Substanzklasse: den Antisense-Antibiotika. Das Prinzip ist so einfach wie genial. Wissenschaftler synthetisieren kurze Moleküle, die das genaue Gegenstück zu mRNA von essenziellen Bakterien-Genen sind und mit dieser einen Doppelstrang bilden. »Wichtig ist, dass man das Start-Codon sowie den Beginn der codierenden Sequenz blockiert«, erklärt Jörg Vogel, Direktor des Helmholtz-Instituts für RNA-basierte Infektionsforschung (HIRI) in Würzburg. Das ist der Ort, an dem normalerweise die Translation, also die Übersetzung in das Protein startet. Durch die Blockade wird die mRNA unlesbar; und ohne die Übersetzungsmaschinen, die Ribosomen, die sich normalerweise über die mRNA bewegen, wird der nun frei liegende Strang schnell abgebaut. Das Ablesen des Gens wird somit verhindert, das Bakterium stirbt oder wird zumindest in seinem Wachstum gebremst.
Sicher blockieren mit RNA-Attrappe
Prinzipiell könnte man einfach passende RNA-Stränge als Antisense-Antibiotika verwenden. Tatsächlich aber benutzt man Moleküle, die sich wie RNAs verhalten, chemisch jedoch etwas anders aufgebaut sind: die so genannten PNA (peptide nucleic acids). Der Grund: Sie sind stabiler. »Der größte Vorteil der PNA ist, dass Bakterien keine Enzyme haben, um diese Moleküle abzubauen«, erklärt Vogel. »RNAs werden dagegen sehr schnell von Endonukleasen zerstört.«
Die PNA tragen die gleichen »Buchstaben« wie die RNA, Nukleinbasen wie Adenin oder Guanin. Doch während diese Basen bei RNA über Zucker-Phosphat-Bindungen verbunden sind, bildet bei den PNA das Rückgrat eine Kette aus der Aminosäure Glycin, mit der die gleichen Abstände der Basen wie bei der RNA erreicht werden. Dadurch kann PNA ebenso effektiv die mRNA der Bakterien blockieren wie ein RNA-Strang.
Doch bis es zu dieser Blockade kommt, sind Hindernisse zu überwinden. Die PNA muss zunächst in die Zelle gelangen. »Gramnegative Bakterien sind von zwei Membranen umgeben, grampositive immerhin von einer«, erklärt Nadja Patenge vom Institut für Medizinische Mikrobiologie der Uni Rostock. »Dazu kommt bei allen Bakterien noch die Zellwand – und einige Arten haben zusätzlich Kapseln.« Erstaunlicherweise gibt es Peptide, die es dennoch ins Zellinnere schaffen, so genannte »cell penetrating peptides« (CPP). »Wie genau der Prozess funktioniert, ist noch nicht verstanden«, sagt Jörg Vogel. »Aber sie lassen sich mit PNAs koppeln, diese kommen so in die Zelle – und wirken so antibiotisch.«
Je länger die blockierenden PNA-Sequenzen sind, umso schwieriger ist es, die Zellbarrieren zu durchdringen. Jörg Vogel hat mit seinem Team zuletzt aber zeigen können, dass bereits PNA aus neun Basen ausreichen, um das Wachstum von Bakterien zu bremsen. »Ein Fortschritt, denn so können wir die Zellmembranen einfacher überwinden«, sagt Vogel. »Auch mit Molekülen aus sieben Basen haben wir meistens schon eine Hemmung erreicht.«
Ein Universalwerkzeug gegen Bakterien
Sobald die Barrieren um die Zelle überwunden sind, ergeben sich mit den Antisense-Antibiotika quasi unbegrenzte Möglichkeiten. »Wir kennen bei Bakterien 50 bis 60 essenzielle Gene, die als Ziel in Frage kommen«, sagt Jörg Vogel. Seine Gruppe versuchte, mehrere dieser Gene zu hemmen. Dabei brachte es die besten Ergebnisse, die mRNA für das so genannte Acyl-Carrier-Protein (acpP) zu attackieren, das eine zentrale Rolle im mikrobiellen Fettstoffwechsel hat. »PNA, die die entsprechende mRNA blockieren, führen innerhalb von Minuten zum Tod von Bakterien in der Petrischale«, sagt Vogel. »In einer Dosis, in der auch andere Antibiotika wirken.« Abgetötet werden konnten so etwa die Darmkeime Escherichia coli und Salmonella enterica, von denen einige Stämme Durchfallerkrankungen hervorrufen.
Das Prinzip funktioniert also – und soll nach dem Willen der Forscher zu einem Werkzeugkasten ausgebaut werden, mit dem sämtliche Bakterien eliminiert werden könnten. Und das gezielt. »Antisense-Antibiotika würden uns ermöglichen, schädliche Bakterien zu zerstören, ohne das gesamte Mikrobiom niederzumähen«, sagt Nadja Patenge. Denn Bakterienspezies unterscheiden sich meistens geringfügig in der Sequenz – selbst von Genen mit der gleichen Funktion wie acpP. »Es ist also vorstellbar, dass wir etwa zehn Gene spezifisch bei einem Bakterium blockieren und so nur diese Art vernichten, während alle anderen Mikroben weiterleben«, sagt Jörg Vogel. Viele der bislang verbreiteten Nebenwirkungen der Antibiotikabehandlung durch Zerstörung des Mikrobioms – wie Durchfall und höhere Anfälligkeit für Allergien – könnten damit der Vergangenheit angehören.
Resistenzen könnten sich auch gegen die Antisense-Antibiotika entwickeln, doch sie ließen sich schneller kontrollieren. Denn wenn sich die Zielsequenz einer solchen Substanz veränderte, könnte recht schnell – ähnlich wie bei den mRNA-Impfstoffen – die Basenabfolge im Therapeutikum so angepasst werden, dass diese wieder passt. »Heute sind die Mediziner machtlos, wenn kein Antibiotikum mehr wirkt«, sagt Nadja Patenge. »Bei Antisense-Antibiotika wäre es denkbar, die DNA des Bakteriums zu sequenzieren und ein angepasstes Präparat zu geben.« Es wäre dafür kein langer Vorlauf wie etwa bei der Herstellung heutiger Grippeimpfstoffe notwendig. »Wir brauchen kein Hühnerei und müssen nicht lange warten, sondern können diese Substanzen einfach chemisch synthetisieren«, sagt Jörg Vogel.
Das Problem ist der Preis
Auch eine Kombination mit den bisher verwendeten Antibiotika wäre möglich – etwa um Resistenzen zu brechen. Antibiotika sind heutzutage meist Stoffe aus der Natur oder solche, die diesen chemisch ähnlich sind. In Bakterien gibt es deshalb durch natürliche Evolution Resistenzgene, die gezielt gegen solche Antibiotika gerichtet sind: Enzyme, die sie unschädlich machen etwa, oder Pumpen, die sie aus der Zelle entfernen. »Mit Antisense-Antibiotika ließen sich solche Resistenzgene gezielt ausschalten – und damit resistente Bakterien wieder empfindlich für Antibiotika machen , sagt Jörg Vogel.
Zudem werden Resistenzgene oft mittels kleiner, ringförmiger DNA zwischen Bakterien ausgetauscht, so dass Bakterien schnell multiresistent werden können. »Denkbar wäre, dass man künftig Antibiotika grundsätzlich zusammen mit einem Antisense-Resistenz-Blocker gibt, sagt Vogel. Ein weiterer Vorteil: Da PNA in der Natur unbekannt sind, haben Bakterien bislang kein Mittel dagegen. »Es ist keine natürliche Resistenz bekannt«, sagt Nadja Patenge.
Bislang ist die Entwicklung allerdings noch in der Grundlagenforschung. Ob die PNA etwa die Magensäure überdauern würden, wurde noch nicht untersucht. »Sie sind aber im Prinzip säure- und hitzestabil«, sagt Nadja Patenge. »Im Moment testen wir lokale Anwendungen im Tierversuch – etwa zum Schmieren auf die Haut gegen Streptokokken und zur Inhalation in die Lunge gegen Pneumokokken. Gegen Streptokokken sei die Wirkung schon sehr gut. Jörg Vogel hat mit seinem Team in der Petrischale die Wirksamkeit gegenüber Erregern von Harnwegsinfektionen getestet, ebenfalls mit gutem Erfolg.
Ob Antisense-Antibiotika jemals zu Medikamenten werden, hängt aber wohl vor allem davon ab, wie sich die Resistenzen gegen die bisher gebräuchlichen Substanzen entwickeln. »Heutige Antibiotika kosten in der Produktion oft nur wenige Cent pro Packung«, sagt Jörg Vogel. »Antisense-Antibiotika wären derzeit wohl noch tausendfach teurer.« In der Massenfertigung würde der Preis natürlich sinken, aber wegen der teuren klinischen Studien würde die Entwicklung bis zur Marktreife wie bei jedem Antibiotikum rund eine Milliarde Euro kosten. »Mein Traum wäre, dass diese Summe aus öffentlichen Geldern bereitgestellt wird«, sagt Jörg Vogel. »Die nächste Pandemie könnte durch ein multiresistentes Bakterium ausgelöst werden – wenn wir die Antisense-Antibiotika bis dahin entwickelt hätten, wären wir gut vorbereitet.«
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.