Krebsforschung: Impfen gegen Krebs
Die Idee ist attraktiv: das Immunsystem mobilisieren, um bei der Krebstherapie gefährliche Tumorzellen auszuschalten. Doch jahrzehntelange Forschung hat gezeigt, dass "attraktiv" noch lange nicht "einfach" heißt.
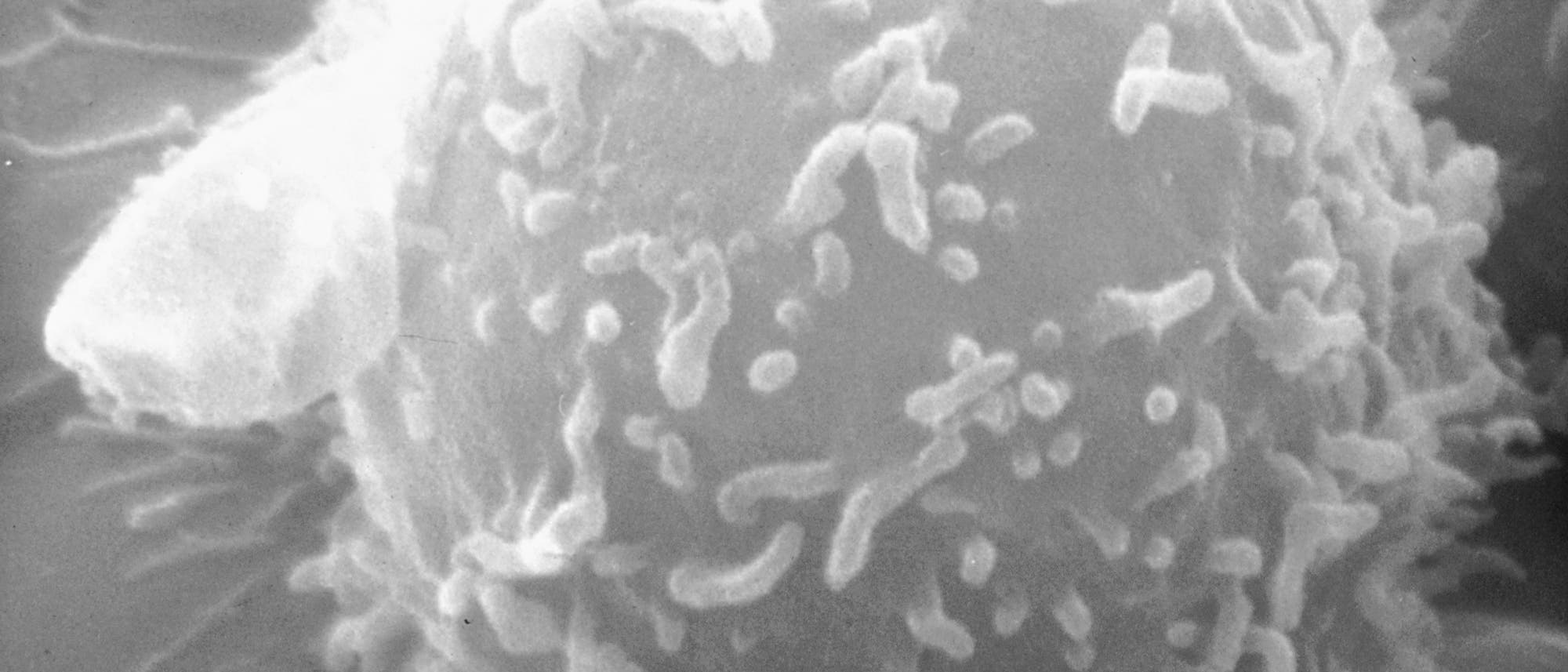
© Timothy Triche, National Cancer Institute, 1976 (Ausschnitt)
Tumoren und das Immunsystem pflegen eine komplizierte Beziehung. So bekommen beispielsweise Menschen mit einem Immundefekt vor allem solche Krebsarten häufiger, an deren Entstehung Viren beteiligt sind. Außerdem haben Krebspatienten eine wesentlich bessere Prognose, wenn sich im Tumorgewebe viele T-Zellen, eine Gruppe spezialisierter Abwehrzellen, aufhalten. Die Idee, das Immunsystem im Kampf gegen Krebs einzusetzen, liegt daher nahe. Und der Einsatz von Antikörpern, die sich gegen Tumorantigene richten, zeigt im Prinzip, dass ein immunologisches Vorgehen gegen Tumorgewebe durchaus möglich ist.
Bis in den klinischen Alltag haben es bislang allerdings nur solche Therapieformen geschafft, bei denen als eine Art "passive Immunisierung" monoklonale Antikörper, die typische Tumormerkmale erkennen, verwendet werden. Diese können in Kombination mit Strahlen- oder Chemotherapie zur Beseitigung von Tumorzellen beitragen. Alle Ansätze, die durch eine regelrechte Impfung die Aufmerksamkeit der Körperabwehr auf das Tumorgewebe lenken wollen, befinden sich noch – mit mehr oder weniger Erfolg – in klinischen Testphasen.
Tumoralarm
Eine Impfung zielt darauf ab, die Abwehrzellen auf einen bereits existierenden Tumor aufmerksam zu machen. Dabei muss man aber bedenken, dass sich das Immunsystem zu diesem Zeitpunkt bereits lange mit den entarteten Zellen auseinandergesetzt hat. Das Immunsystem ist bereits während des Tumorwachstums von den Krebszellen ausgetrickst worden, hob Stephan Kießig, Immunologe und wissenschaftlicher Leiter der Firma LipoNova AG unlängst auf den "Impfstofftagen" hervor, die anlässlich der Messe "Biotechnica" in Hannover veranstaltet wurden.
So regulieren manche Krebszellen verräterische Moleküle herunter und werden auf diese Weise für das Immunsystem unsichtbar. Andere reagieren weniger empfindlich auf die Mechanismen, mit denen die Abwehrzellen sie aus dem Weg schaffen wollen. Tumorzellen können außerdem Botenstoffe ausschütten, die wichtige Abwehrzellen lahmlegen oder gar so genannte regulatorische T-Zellen anlocken, die ihrerseits verschiedenen Akteure des Immunsystems hemmen. Um trotzdem das Potenzial der Körperabwehr für Angriffe auf das Tumorgewebe zu nutzen, werden eine Fülle trickreicher Strategien erprobt.
Eine Datenbank der US-amerikanischen National Institutes of Health, listet denn auch nach Eingabe der Suchbegriffe "vaccine" und "cancer" derzeit 229 geplante oder laufende klinische Studien auf. Darunter finden sich auch solche, bei denen die Patienten mit kompletten Tumorzellen geimpft werden. Verwendet werden im Kampf gegen zum Beispiel Nieren- oder Hautkrebs abgetötete Krebszellen, die vom Patienten selbst stammen. Solche "autologen" Tumorzell-Impfstoffe haben den Vorteil, dass sie genau diejenigen Merkmale enthalten, die tatsächlich ganz individuell auf den Krebszellen des Patienten vorliegen und gegen die sich die Immunantwort schließlich richten soll. Dieses Antigenmuster sei sehr variabel und bei jedem Krebspatienten unterschiedlich, betonte Stephan Kießig auf der Biotechnica. Der Nachteil: die Herstellung eines solchen individuellen Impfstoffes ist zeitaufwändig, und nicht immer ist ausreichend Tumormaterial vorhanden, um daraus einen Impfstoff herstellen zu können.
Bote an Bord
Als Ausweg werden daher häufig auch solche Impfstoffe verwendet, die von Tumorzelllinien stammen. Thomas Brill vom Institut für experimentelle Onkologie und Therapieforschung an der Technischen Universität München stellte auf den Impfstofftagen die Ergebnisse eines klinischen Tests vor, bei dem Prostatakrebspatienten mehrmals mit einer solchen "allogenen" Zelllinie geimpft worden waren. Diese so genannten LNCaP-Zellen waren zuvor bestrahlt und gentechnisch so verändert worden, dass sie als zusätzlichen Stimulus die immunologischen Botenstoffe Interleukin-2 und Interferon-Gamma freisetzen.
Die Impfung erfolgte über die Haut, wodurch dendritische Zellen des Immunsystems aktiv wurden, die in das Tumorgewebe einwanderten, erklärte Thomas Brill. Rund siebzig Prozent der dreißig Patienten sprachen auf die Therapie an, und es ließ sich eine Immunantwort gegen eine Reihe von Tumorantigenen nachweisen. Im Durchschnitt verlängerte sich die Verdopplungszeit des Protstata-spezifischen Antigens (PSA, hier als Maß für das Fortschreiten der Krankheit verwendet) von 63 auf 114 Tagen. Ein – wenn auch bescheidener – Erfolg, was wohl auch damit zu tun hat, dass ausschließlich Patienten in fortgeschrittenem Krankheitsstadium beteiligt waren. Thomas Brill wies in diesem Zusammenhang darauf hin, dass es generell schwierig ist, auf immunologischer Ebene den "Erfolg" einer solchen Impfung zu bestimmen. In der Tat wird in vielen Studien nur die T-Zellantwort oder Antikörperausschüttung im Blut gemessen, was nicht unbedingt mit deren Anwesenheit im Tumorgewebe übereinstimmen muss.
Warum die Körperabwehr ganz offensichtlich mit aller Macht zum Angriff auf das Tumorgewebe "überredet" werden muss, hat neben den Ausweichstrategien des Tumors selbst sicher auch damit zu tun, dass die Krebszellen häufig so genannte tumorassoziierte Antigene (TAA) tragen. Diese finden sich zwar überwiegend auf Tumorgewebe, können aber, möglicherweise in geringerer Anzahl, auch auf normalen Körperzellen auftauchen. Entscheidend für die Entwicklung erfolgreicher Tumorimpfstoffe wird es jedoch sein, das Immunsystem zu Angriffen auf solche Moleküle zu bewegen, die als Folge der Krankheit für das Immunsystem wirklich neu und damit für die Immunabwehr fremd sind. Diese tumorspezifischen Antigene (TSA) sind Moleküle, die entweder von Viren stammen oder durch die Veränderung körpereigener Antigene entstanden sind.
Fremd gleich Feind
Denn die Zellen des Immunsystems lernen während ihrer Reifung gerade, körpereigene Strukturen zu verschonen und nur fremde anzugreifen. Diese erlernte Toleranz bei einer Tumorimpfung zu durchbrechen, ist schwierig und läuft stets Gefahr, eine Autoimmunreaktion gegen andere Körpergewebe auszulösen. Einen interessanten Weg, jene Strukturen zu entdecken, die für das Immunsystem wirklich "neu" also "fremd" sind, hat Bruno Kyewski vom Deutschen Krebsforschungszentrum in Heidelberg entdeckt. Kyewski versucht, in die Lehrbücher der Immunabwehrschule zu schauen, die im Thymus, einem kleinen Organ hinter dem Brustbein, abgehalten wird.
Hier werden den Abwehrzellen im Rahmen ihrer Ausbildung alle Molekülstrukturen präsentiert, die der Körper zu bieten hat. Diejenigen Abwehrzellen, die mit körpereigenen Molekülen reagieren, sterben ab. Nur solche, die potenzielle Fremdantigene erkennen, werden in den Körper entlassen. In Zusammenarbeit mit einer niederländischen Forschergruppe konnte Kyewskis Team kürzlich zeigen, dass zum Anschauungsmaterial, welches den Abwehrzellen im Thymus präsentiert wird, auch die beiden tumorassoziierten Antigene MUC1 und CEA gehören.
Bei genauerer Analyse stellte sich jedoch heraus, dass im Falle von MUC1 nur gegen solche Moleküle eine Toleranz erzeugt wird, die in typischer Weise mit Zuckermolekülen bestückt sind [1]. Abweichend verzuckerte MUC1-Moleküle, wie man sie nur auf Tumorzellen findet, standen dagegen nicht im Thymuslehrbuch. Daher stellt diese Variante einen interessanten Kandidaten dar, gegen den über eine Impfung eine gute Immunantwort erzeugt werden könnte.
"Es ist nicht überraschend, dass Tumorzellen häufig mit ungewöhnlichen Zuckermolekülen dekoriert sind", sagt Geert-Jan Boons von der Universität von Georgia im US-amerikanischen Athens. Geert-Jan Boons Team hat unlängst mit Hilfe eines Impfstoffes, der sich aus drei verschiedenen Komponenten zusammensetzt, in Experimenten an Mäusen eine gute Immunantwort gegen jene veränderten Zuckermoleküle auslösen können [2].
Der Impfstoff sei komplett synthetisch hergestellt, erklärt der Chemiker Boons. Er enthält den für manche Tumoren typischen Zuckeranteil des Proteins MUC1, daran gekoppelt ein kurzes Eiweißstückchen, das spezielle T-Zellen aktiviert, sowie einen Hilfsstoff, der das Immunsystem zusätzlich in erhöhte Alarmbereitschaft versetzt. Durch die Herstellungsform dieses Impfstoffes wird es möglich sein, alle drei Komponenten je nach Bedarf zu verändern und zu optimieren. Erste klinische Studien am Menschen sind für etwa in einem Jahr geplant. Dann wird sich zeigen, ob die angekurbelte Immunreaktion stark genug ist, einem Tumorwachstum oder einer Metastasierung entgegen zu wirken.
Bis in den klinischen Alltag haben es bislang allerdings nur solche Therapieformen geschafft, bei denen als eine Art "passive Immunisierung" monoklonale Antikörper, die typische Tumormerkmale erkennen, verwendet werden. Diese können in Kombination mit Strahlen- oder Chemotherapie zur Beseitigung von Tumorzellen beitragen. Alle Ansätze, die durch eine regelrechte Impfung die Aufmerksamkeit der Körperabwehr auf das Tumorgewebe lenken wollen, befinden sich noch – mit mehr oder weniger Erfolg – in klinischen Testphasen.
Tumoralarm
Eine Impfung zielt darauf ab, die Abwehrzellen auf einen bereits existierenden Tumor aufmerksam zu machen. Dabei muss man aber bedenken, dass sich das Immunsystem zu diesem Zeitpunkt bereits lange mit den entarteten Zellen auseinandergesetzt hat. Das Immunsystem ist bereits während des Tumorwachstums von den Krebszellen ausgetrickst worden, hob Stephan Kießig, Immunologe und wissenschaftlicher Leiter der Firma LipoNova AG unlängst auf den "Impfstofftagen" hervor, die anlässlich der Messe "Biotechnica" in Hannover veranstaltet wurden.
So regulieren manche Krebszellen verräterische Moleküle herunter und werden auf diese Weise für das Immunsystem unsichtbar. Andere reagieren weniger empfindlich auf die Mechanismen, mit denen die Abwehrzellen sie aus dem Weg schaffen wollen. Tumorzellen können außerdem Botenstoffe ausschütten, die wichtige Abwehrzellen lahmlegen oder gar so genannte regulatorische T-Zellen anlocken, die ihrerseits verschiedenen Akteure des Immunsystems hemmen. Um trotzdem das Potenzial der Körperabwehr für Angriffe auf das Tumorgewebe zu nutzen, werden eine Fülle trickreicher Strategien erprobt.
Eine Datenbank der US-amerikanischen National Institutes of Health, listet denn auch nach Eingabe der Suchbegriffe "vaccine" und "cancer" derzeit 229 geplante oder laufende klinische Studien auf. Darunter finden sich auch solche, bei denen die Patienten mit kompletten Tumorzellen geimpft werden. Verwendet werden im Kampf gegen zum Beispiel Nieren- oder Hautkrebs abgetötete Krebszellen, die vom Patienten selbst stammen. Solche "autologen" Tumorzell-Impfstoffe haben den Vorteil, dass sie genau diejenigen Merkmale enthalten, die tatsächlich ganz individuell auf den Krebszellen des Patienten vorliegen und gegen die sich die Immunantwort schließlich richten soll. Dieses Antigenmuster sei sehr variabel und bei jedem Krebspatienten unterschiedlich, betonte Stephan Kießig auf der Biotechnica. Der Nachteil: die Herstellung eines solchen individuellen Impfstoffes ist zeitaufwändig, und nicht immer ist ausreichend Tumormaterial vorhanden, um daraus einen Impfstoff herstellen zu können.
Bote an Bord
Als Ausweg werden daher häufig auch solche Impfstoffe verwendet, die von Tumorzelllinien stammen. Thomas Brill vom Institut für experimentelle Onkologie und Therapieforschung an der Technischen Universität München stellte auf den Impfstofftagen die Ergebnisse eines klinischen Tests vor, bei dem Prostatakrebspatienten mehrmals mit einer solchen "allogenen" Zelllinie geimpft worden waren. Diese so genannten LNCaP-Zellen waren zuvor bestrahlt und gentechnisch so verändert worden, dass sie als zusätzlichen Stimulus die immunologischen Botenstoffe Interleukin-2 und Interferon-Gamma freisetzen.
Die Impfung erfolgte über die Haut, wodurch dendritische Zellen des Immunsystems aktiv wurden, die in das Tumorgewebe einwanderten, erklärte Thomas Brill. Rund siebzig Prozent der dreißig Patienten sprachen auf die Therapie an, und es ließ sich eine Immunantwort gegen eine Reihe von Tumorantigenen nachweisen. Im Durchschnitt verlängerte sich die Verdopplungszeit des Protstata-spezifischen Antigens (PSA, hier als Maß für das Fortschreiten der Krankheit verwendet) von 63 auf 114 Tagen. Ein – wenn auch bescheidener – Erfolg, was wohl auch damit zu tun hat, dass ausschließlich Patienten in fortgeschrittenem Krankheitsstadium beteiligt waren. Thomas Brill wies in diesem Zusammenhang darauf hin, dass es generell schwierig ist, auf immunologischer Ebene den "Erfolg" einer solchen Impfung zu bestimmen. In der Tat wird in vielen Studien nur die T-Zellantwort oder Antikörperausschüttung im Blut gemessen, was nicht unbedingt mit deren Anwesenheit im Tumorgewebe übereinstimmen muss.
Warum die Körperabwehr ganz offensichtlich mit aller Macht zum Angriff auf das Tumorgewebe "überredet" werden muss, hat neben den Ausweichstrategien des Tumors selbst sicher auch damit zu tun, dass die Krebszellen häufig so genannte tumorassoziierte Antigene (TAA) tragen. Diese finden sich zwar überwiegend auf Tumorgewebe, können aber, möglicherweise in geringerer Anzahl, auch auf normalen Körperzellen auftauchen. Entscheidend für die Entwicklung erfolgreicher Tumorimpfstoffe wird es jedoch sein, das Immunsystem zu Angriffen auf solche Moleküle zu bewegen, die als Folge der Krankheit für das Immunsystem wirklich neu und damit für die Immunabwehr fremd sind. Diese tumorspezifischen Antigene (TSA) sind Moleküle, die entweder von Viren stammen oder durch die Veränderung körpereigener Antigene entstanden sind.
Fremd gleich Feind
Denn die Zellen des Immunsystems lernen während ihrer Reifung gerade, körpereigene Strukturen zu verschonen und nur fremde anzugreifen. Diese erlernte Toleranz bei einer Tumorimpfung zu durchbrechen, ist schwierig und läuft stets Gefahr, eine Autoimmunreaktion gegen andere Körpergewebe auszulösen. Einen interessanten Weg, jene Strukturen zu entdecken, die für das Immunsystem wirklich "neu" also "fremd" sind, hat Bruno Kyewski vom Deutschen Krebsforschungszentrum in Heidelberg entdeckt. Kyewski versucht, in die Lehrbücher der Immunabwehrschule zu schauen, die im Thymus, einem kleinen Organ hinter dem Brustbein, abgehalten wird.
Hier werden den Abwehrzellen im Rahmen ihrer Ausbildung alle Molekülstrukturen präsentiert, die der Körper zu bieten hat. Diejenigen Abwehrzellen, die mit körpereigenen Molekülen reagieren, sterben ab. Nur solche, die potenzielle Fremdantigene erkennen, werden in den Körper entlassen. In Zusammenarbeit mit einer niederländischen Forschergruppe konnte Kyewskis Team kürzlich zeigen, dass zum Anschauungsmaterial, welches den Abwehrzellen im Thymus präsentiert wird, auch die beiden tumorassoziierten Antigene MUC1 und CEA gehören.
Bei genauerer Analyse stellte sich jedoch heraus, dass im Falle von MUC1 nur gegen solche Moleküle eine Toleranz erzeugt wird, die in typischer Weise mit Zuckermolekülen bestückt sind [1]. Abweichend verzuckerte MUC1-Moleküle, wie man sie nur auf Tumorzellen findet, standen dagegen nicht im Thymuslehrbuch. Daher stellt diese Variante einen interessanten Kandidaten dar, gegen den über eine Impfung eine gute Immunantwort erzeugt werden könnte.
"Es ist nicht überraschend, dass Tumorzellen häufig mit ungewöhnlichen Zuckermolekülen dekoriert sind", sagt Geert-Jan Boons von der Universität von Georgia im US-amerikanischen Athens. Geert-Jan Boons Team hat unlängst mit Hilfe eines Impfstoffes, der sich aus drei verschiedenen Komponenten zusammensetzt, in Experimenten an Mäusen eine gute Immunantwort gegen jene veränderten Zuckermoleküle auslösen können [2].
Der Impfstoff sei komplett synthetisch hergestellt, erklärt der Chemiker Boons. Er enthält den für manche Tumoren typischen Zuckeranteil des Proteins MUC1, daran gekoppelt ein kurzes Eiweißstückchen, das spezielle T-Zellen aktiviert, sowie einen Hilfsstoff, der das Immunsystem zusätzlich in erhöhte Alarmbereitschaft versetzt. Durch die Herstellungsform dieses Impfstoffes wird es möglich sein, alle drei Komponenten je nach Bedarf zu verändern und zu optimieren. Erste klinische Studien am Menschen sind für etwa in einem Jahr geplant. Dann wird sich zeigen, ob die angekurbelte Immunreaktion stark genug ist, einem Tumorwachstum oder einer Metastasierung entgegen zu wirken.


Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.