Lexikon der Chemie: Glaszustand
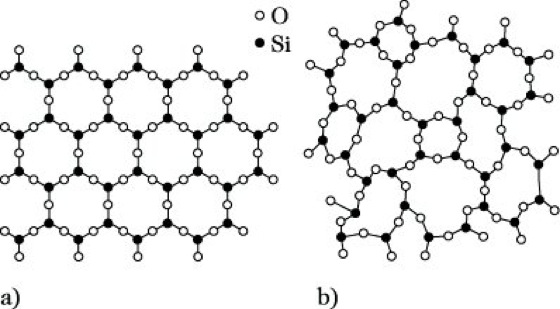
Glaszustand, glasartiger Zustand, glasiger Zustand, amorphe Zustandsform fester Stoffe, die man durch Unterkühlung einer Schmelze erhält. Der Übergang eines Stoffes vom flüssigen in den fest-kristallinen Aggregatzustand beim Abkühlen setzt die Anwesenheit wachstumsfähiger Kristallkeime und ein genügend schnelles Kristallwachstum voraus. Die Kristallisation kann trotz Unterschreitens der Erstarrungstemperatur ausbleiben, wenn die Keimbildungsgeschwindigkeit und/oder die Kristallwachstumsgeschwindigkeit zu gering ist. Die Teilchen nehmen dann keine Kristallgitterplätze ein, sondern frieren bei weiterer Abkühlung allmählich in der für Flüssigkeiten typischen Teilchenanordnung (Aggregatzustand) ein (Abb.). Man kann deshalb ein Glas als eine eingefrorene unterkühlte Schmelze definieren. Wie alle amorphen Stoffe hat ein Glas keinen definierten Schmelzpunkt, der wechselseitige Übergang zwischen G. und flüssigem Zustand erfolgt kontinuierlich. Alle physikalischen Eigenschaften ändern sich dabei ebenfalls stetig. Lage und Ausdehnung des Einfrier- und Erweichungsbereiches hängen von der Abkühlungs- bzw. Aufheizgeschwindigkeit ab. Den Bereich besonders starker – aber nicht sprunghafter – Eigenschaftsänderungen bezeichnet man als Transformationsbereich.
Ob bei der Abkühlung einer Schmelze der G. realisierbar ist oder ob Kristallisation einsetzt, hängt sowohl vom Stoffsystem als auch von den experimentellen Bedingungen ab. Besonders zur Glasbildung neigen eine Reihe von Oxiden, wie SiO2, BeO, As2O3 oder P2O5. Gläser lassen sich aber auch von vielen anderen Verbindungen, von Elementen (z. B. Schwefel, Selen, Phosphor und Kohlenstoff), organischen Hochpolymeren und wäßrigen Lösungen (z. B. Wasserstoffperoxid, Perchlorsäure, Kaliumhydroxid u. a.) herstellen. Dagegen reichen selbst die höchsten bisher erzielbaren Abkühlungsgeschwindigkeiten von 106 K s-1 noch nicht aus, um das glasige Erstarren von Natriumchlorid oder Aluminiumoxid zu erzwingen.
Stoffe im G. besitzen eine große Bedeutung als Werkstoffe (Glas).
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.