Lexikon der Chemie: Ethin
Ethin, Acetylen, HC≡CH, das Anfangsglied der homologen Reihe der Alkine. E. ist ein farbloses, brennbares, in reinstem Zustand fast geruchloses und narkotisch wirkendes Gas; F. -81,5 °C, Kp. -83,8 °C, Heizwert 57000 kJ/m3. Das aus Carbid entwickele technische Acetylengas hat einen charakteristischen, unangenehmen Geruch, der auf Verunreinigungen, wie Phosphorwasserstoff (Phosphin), Schwefelwasserstoff, Thioalkohole, zurückzuführen ist. E. löst sich leicht in Wasser und noch leichter in Aceton. Bei 0 °C und 2,18 MPa kann es zu einer Flüssigkeit verdichtet werden. E. ist leicht entzündbar und brennt mit sehr heller, stark rußender Flamme, die etwa 1900 °C, mit Sauerstoff gemischt bis über 3000 °C heiß wird.
Die Instabilität des E. hängt mit seinem hohen Energiegehalt zusammen. Für die Synthese aus den Elementen sind fast 220 kJ/mol notwendig.
Ethin hat den größten Explosionsbereich aller Brenngase. Der explosionsartige Zerfall in Kohlenstoff und Wasserstoff erfolgt bei einem Druck über 0,2 MPa bereits in der Kälte, unter Normaldruck ab 150 °C. Ethin-Luft-Gemische sind bei einem Gehalt von 2,3 bis 82 Vol.-% Ethin explosibel.
Ethin und entsprechende homologe Alkine dürfen nicht mit Kupfer oder Silber in Berührung kommen (Gefäße oder Rohrleitungen!), da sich hierbei hochexplosives Kupfer- oder Silberacetylid bildet; ausgenommen ist Messing mit einem Kupfergehalt bis 65 %. Dies gilt nicht für Arbeiten, bei denen diese Metalle als Katalysator verwendet werden.
Zur Verhinderung der Explosionsgefahr wird Acetylengas zur Speicherung in Stahlflaschen unter Druck bis zu 1,5 MPa in Aceton gelöst, das man mit einer porösen Masse, meist Kieselgur, aufsaugt; es entsteht Dissousgas. Im E. und in den Monoalkylethinen R-C≡CH hat der Wasserstoff sauren Charakter und kann durch Metall ersetzt werden, z. B. HC≡CH + 2 Cu+ → CuC≡CCu + 2 H+. Diese Salze bezeichnet man als Acetylide.
Der stark ungesättigte Zustand und der hohe Energiegehalt des E. bedingen seine außerordentlich große chem. Reaktionsfähigkeit. Die von ihm ausgehenden chem. Reaktionen werden unter dem Sammelbegriff Acetylenchemie zusammengefaßt. Über Analytisches Alkine.
Herstellung. E. wird großtechnisch besonders nach zwei Verfahren hergestellt: 1) Zersetzung von Calciumcarbid mit Wasser: CaC2 + 2 H2O → C2H2 + Ca(OH)2. Diese Umsetzung des Calciumcarbids erfolgt bei Wasserüberschuß im Naßentwickler oder bei etwa stöchiometrischen Wassermengen im Trockenentwickler (Abb.), so daß ein rieselfähiges Kalkhydratpulver (Carbidkalk) anfällt. Der Carbidkalk wird im Bauwesen, in der chem. Industrie oder in der Landwirtschaft verarbeitet. Aus 1 kg Carbid erhält man je nach Reinheit 230 bis 300 l technisches E.
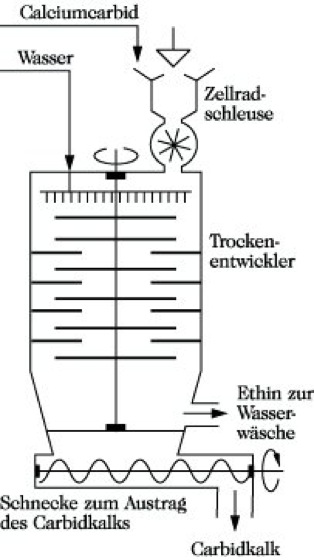
Ethin. Abb.: Erzeugung aus Calciumcarbid im Trockenentwickler.
2) Hochtemperaturpyrolyse von Kohlenwasserstoffen, insbesondere von Methan (Pyrolyse). Grundprinzip dieser Verfahren ist eine schnelle Energiezufuhr auf ein Temperaturniveau oberhalb 1500 °C, extrem niedrige Verweilzeit von nur 10-2 bis 10-3 Sekunden im Reaktor, niedriger Partialdruck des E. und eine schnelle Abkühlung des Pyrolysegases (quenchen). Der Ethingehalt im Spaltgas beträgt etwa 5 bis 18 %. Mit Hilfe eines selektiven Lösungsmittels, z. B. Dimethylformamid, N-Methyl-pyrrolidon oder Aceton, wird das E. aus dem Gasgemisch herausgewaschen und in weiteren Verfahrensstufen aufgearbeitet. Vom Grundsatz her kann zwischen drei Verfahrensvarianten unterschieden werden: a) allotherme Verfahren mit direkter Wärmeübertrag, z. B. das seit 1940 betriebene Hüls-Lichtbogenverfahren und die Wasserstoff-Lichtbogenpyrolyse (Plasma-Verfahren), b) allotherme Verfahren mit indirekter Wärmeübertragung durch einen Wärmeträger; hierzu gehören der Wulff-Prozeß, der nach dem Regenerativprinzip mit alternierender Aufheizung und nachfolgender Spaltung arbeitet, und das Kureha-Verfahren (Pyrolyse), sowie c) autotherme Verfahren, bei denen die notwendige Wärmeenergie durch Teilverbrennung des Einsatzproduktes gewonnen wird. Am meisten angewandt wird das Sachse-Verfahren. Außerdem zählen zu dieser Gruppe der Tauchflammenprozeß und das HTP-Verfahren (Abk. von Hochtemperatur-Pyrolyse-Verfahren).
Die Hauptmenge E. für die chem. Industrie wird über petrochemische Verfahren gewonnen. Ein neuer Aspekt der Erzeugung von E. ergibt sich aus dem internationalen Trend, die Temperaturen bei der Ethengewinnung bis fast an 1000 °C heranzuführen. Damit steigt zwangsläufig der Ethingehalt in der C2-Fraktion, so daß eine Isolierung wirtschaftlich wird.
Verwendung. E. gehört zu den wichtigsten Ausgangsprodukten der organischen chem. Industrie (Acetylenchemie). Das E. wurde in den letzten Jahren bei vielen chem. Synthesen durch das wesentlich billigere Ethen ersetzt, jedoch einige Verbindungen, z. B. Butan-1,4-diol und die Vinylester, können z. Z. nur aus E. wirtschaftlich hergestellt werden. E. wird wegen seines hohen Heizwertes in erheblichem Umfang als Brenn-, Schneid- und Schweißgas verwendet. Man nutzt dabei die über 3000 °C heiße Flamme des verbrennenden E.-Sauerstoff-Gemisches aus. Bei der sauerstoffarmen Verbrennung von E. erhaltener Ruß (Acetylenschwarz) dient als Füllmittel und zur Herstellung von Wasser- und Ölfarbe. Polymere des E. gewinnen zunehmend für die Mikroelektronik an Bedeutung.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.