Lexikon der Chemie: Grignard-Reaktionen
Grignard-Reaktionen, Grignard-Synthesen, die vor allem von V. Grignard (1871-1935) untersuchten Additionsreaktionen von Grignard-Verbindungen an die Carbonyldoppelbindung sowie an andere polare Mehrfachbindungen, wie /C=O, /C=S, /C =N-, /S=O, -N=O, -C≡N. Die C=C-Doppel- und C≡C-Dreifachbindungen reagieren nur dann mit Grignard-Verbindungen, wenn sie Bestandteil eines konjugierten Systems mit einer der oben genannten funktionellen Gruppen sind und auf diese Weise aktiviert werden. Formal wird bei G. der Magnesiumhalogenrest als Kation an das elektronegativere Element und der Kohlenwasserstoffrest als Anion an das positivierte Element der polaren Mehrfachbindung addiert:
Durch anschließende Hydrolyse des Additionsproduktes wird unter Abspaltung von Mg(OH)X der entsprechende Alkohol gebildet:
Im Sinne dieser allg. Formulierung reagiert Formaldehyd mit Grignard-Verbindungen unter Bildung von primären Alkoholen:
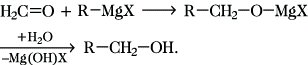
Aus höheren Aldehyden werden unter den gleichen Reaktionsbedingungen sekundäre Alkohole gebildet. Ketone und Carbonsäureester reagieren mit Grignard-Verbindungen unter Bildung tertiärer Alkohole. Aus Carbonsäureestern bilden sich bei dieser Reaktion intermediäre Ketone, die aber nicht isoliert werden können, da sie aufgrund ihrer höheren Carbonylaktivität schneller mit dem Grignard-Reagens weiterreagieren als die eingesetzten Ester:
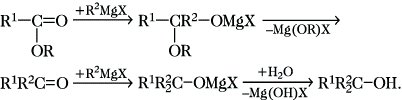
Bei der Reaktion von Ameisensäureestern können die als Zwischenprodukte entstehenden Aldehyde isoliert werden. Dieser Reaktionsverlauf kann durch einen Esterüberschuß begünstigt werden. Ähnlich wie mit Carbonsäureestern reagieren Grignard-Verbindungen mit Carbonsäurehalogeniden, Carbonsäureanhydriden, N-substituierten Carbonsäureamiden sowie Carbonsäuresalzen unter Bildung tertiärer Alkohole, wobei in diesen Fällen die primär entstehenden Ketone isoliert werden können.
Bei der Einwirkung von Kohlendioxid auf Grignard-Verbindungen entstehen bei tiefen Temperaturen in guten Ausbeuten die entsprechenden Carbonsäuren:
Genauso kann Schwefeldioxid mit Grignard-Verbindungen in Sulfinsäuren umgewandelt werden:
Bei der Umsetzung von Schwefelkohlenstoff mit Grignard-Verbindungen können die primär entstehenden Additionsprodukte durch Alkylierung in Dithiocarbonsäureester übergeführt werden:
Nitrile reagieren mit Grignard-Verbindungen über teilweise isolierbare Ketimine unter Bildung von Ketonen:

Die Synthese einer Reihe von Kohlenwasserstoffen aus Grignard-Verbindungen gelingt durch die Wurtz-Grignard-Reaktion durch Umsetzungen mit reaktiven Halogenkohlenwasserstoffen. Kohlenwasserstoffe entstehen auch bei der Umsetzung von Grignard-Verbindungen mit Reaktionspartnern, die ein aktives Wasserstoffatom enthalten, z. B. Wasser, Alkohole, Phenole, Enole, Carbonsäuren sowie primäre und sekundäre Amine: R-MgX + H-OH → R-H + Mg(OH)X. Bei der Zerewitinoff-Methode wird diese Reaktion zur quantitativen Bestimmung aktiver H-Atome verwendet. Als Lösungsmittel können bei G. außer Diethylether auch Dibutylether, Anisol, Tetrahydrofuran sowie Methylenchlorid eingesetzt werden.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.