Lexikon der Chemie: Heßscher Satz
Heßscher Satz, ältere Bezeichnung Gesetz der konstanten Wärmesummen, eine spezielle Anwendung des 1. Hauptsatzes der Thermodynamik. Dabei ist bei verschiedenen Reaktionswegen mit den gleichen Ausgangs- und Endstoffen die Summe der Reaktionswärmen auf jedem dieser Wege gleich. Die Reaktionsenergien ΔRU und Reaktionsenthalpien ΔRH sind Änderungen thermodynamischer Zustandsgrößen und dürfen nicht vom Weg der Prozeßführung abhängen. Der H. S. ist das grundlegende Gesetz der Thermochemie. Er ermöglicht die Ermittlung von Bildungsenthalpien ΔBH und -energien ΔBU aus experimentell gemessenen Verbrennungswärmen ΔVH bzw. ΔVU sowie die Berechnung von Reaktionsenthalpien, die einer Messung nicht zugänglich sind. Beispiel:
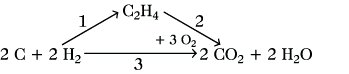
Nach dem H. S. ist die Summe der Reaktionsenthalpien der Teilschritte 1 und 2 ΔRH1 und ΔRH2 gleich der Reaktionsenthalpie ΔRH3 auf dem alternativen Weg : ΔRH1 + ΔRH2 = ΔRH3. Die Reaktionsenthalpie der Reaktion 1 ist gleich der Bildungsenthalpie von Ethen: ΔRH1 = ΔBHC2H4. ΔRH1 ist experimentell nicht meßbar. Demgegenüber ist ΔRH2 gleich der Verbrennungsenthalpie ΔvHC2H4 von Ethen und kalorimetrisch zugänglich. Die direkte Verbrennungsreaktion 3 ist gleichfalls meßbar: ΔRH3 = 2ΔBHCO2 + 2ΔBHH2O. Damit ergibt sich die Bildungsenthalpie von Ethen aus dem H. S. zu ΔBHC2H4 = 2ΔBHCO2 + 2ΔBHH2O - ΔvHC2H4.
Der H. S. ist auch auf Phasenumwandlungswärmen anwendbar und besagt z. B., daß die Sublimationsenthalpie gleich der Summe aus Schmelz- und Verdampfungsenthalpie (bei gleicher Temperatur) ist.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.