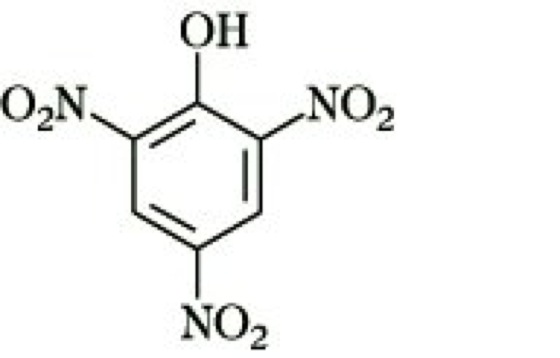
Lexikon der Chemie: Pikrinsäure
Pikrinsäure, 2,4,6-Trinitrophenol, gelbe, stark bitter schmeckende Kristalle; F. 122 °C. P. ist in kaltem Wasser schwer löslich, dagegen löslich in siedendem Wasser und leicht löslich in Ethanol und Benzol. P. ist eine starke Säure (pKS 1,02), bedingt durch die Anhäufung elektronenziehender Substituenten, die die Acidität der phenolischen Hydroxygruppe maßgeblich erhöhen (Dinitrophenole). Sehr gut kristallisierende Salze, die Pikrate, gibt P. mit vielen organischen Basen, die dadurch charakterisiert werden können. Mit kondensierten aromatischen Kohlenwasserstoffen entstehen definierte farbige Molekülverbindungen, die den Charakter von charge-transfer-Komplexen haben und ebenfalls Pikrate genannt werden. Sie sind schwer löslich und scharf schmelzend und dienen deshalb zur Isolierung und Charakterisierung der entsprechenden Arene.
P. ist giftig. Hautkontakte und das Einatmen von Dämpfen und Stäuben ist zu vermeiden. Seide, Wolle, Leder, die menschliche Haut und andere Proteine werden gelb gefärbt, wenn sie mit wäßriger Lösung von P. behandelt werden. Damit ist P. ein Farbstoff (Nitrofarbstoff), der aber wegen zu geringer Echtheit der Färbung und seiner Giftigkeit bedeutungslos geworden ist.
P. verbrennt beim Entzünden an der Luft mit starker Rauchentwicklung, bei sehr raschem Erhitzen oder Initialzündung erfolgt äußerst heftige Explosion. Die Detonationsgeschwindigkeit beträgt 7100 m/s. Damit ist P. in der Sprengkraft 10 bis 15 % stärker als 2,4,6-Trinitrotoluol (TNT) und wurde im 1. Weltkrieg zur Granatenfüllung eingesetzt. Wegen der Aggressivität gegenüber Metallen und der Bildung unkontrolliert explodierender Schwermetallpikrate ist es von TNT verdrängt worden. Chemisch läßt sich P. abwandeln zu Pikraminsäure und Pikrylchlorid und von dort weiter zu Pikramid. Hergestellt wird P. aus Phenol, d. h. Überführung in Phenol-2,4-disulfonsäure und Behandlung mit konz. Salpetersäure. Verwendet wird P. insbesondere in der Farbstoffindustrie zur Herstellung der Pikraminsäure sowie in der organischen Analytik.




Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.