Lexikon der Chemie: Formel
Formel, Beschreibung von Zusammensetzung, Bindung und evtl. räumlicher Anordnung der Atome im Molekül einer chem. Verbindung durch Symbole. Es werden verschiedene F.-Arten unterschieden, die für anorganische und organische Verbindungen nach unterschiedlichen Prinzipien aufgestellt werden: Der elektropositive Bestandteil von Salzen, das Kation, soll stets an erster Stelle stehen. Enthält eine Verbindung mehrere elektropositive oder mehrere elektronegative Bestandteile, so werden die Symbole in diesen Gruppen jeweils alphabetisch geordnet, unter den Kationen wird H stets zuletzt genannt. Bei binären Verbindungen aus Nichtmetallen gilt der in nachstehender Reihenfolge zuerst genannte als der elektropositive: Rn, Xe, Kr, Ar, Ne, He, B, Si, C, Sb, As, P, N, H, Te, Se, S, At, I, Br, Cl, O, F, z. B. für Siliciumtetrafluorid SiF4, Sauerstofffluorid OF2. Für Elemente, die hierbei nicht enthalten sind, gilt die in der Abb. gegebene Folge in Pfeilrichtung; kommt ein Element nur in der Abb., das andere in obiger Reihenfolge vor, so wird das in dieser Reihe genannte als das elektronegativere angesehen. Sind drei oder mehr Elemente kettenförmig verbunden, so soll die Reihenfolge in der F. mit der im Molekül oder im Ion übereinstimmen, z. B. HOCN für Cyansäure, HONC für Isoknallsäure. Sind zwei oder mehr verschiedene Atome oder Gruppen mit einem einzelnen Zentralatom verbunden, so wird das Symbol des Zentralatoms an die erste Stelle gesetzt; ihm folgen die Symbole der übrigen Atome oder Gruppen in alphabetischer Reihenfolge, z. B. PBrCl2. In den F. anorganischer Säuren steht der Wasserstoff immer an erster Stelle. In F. intermetallischer Verbindungen werden die Symbole der metallischen Bestandteile (Sb rechnet als Metall) alphabetisch angeordnet, wenn nicht z. B. der salzartige Charakter hervorgehoben werden soll. In F. z. B. für Einlagerungsverbindungen folgen die Symbole der Nichtmetalle (in der oben angegebenen Folge) hinter denen der Metalle. Die Anzahl gleichartiger Atome oder Atomgruppen in der F. wird durch arabische Ziffern angegeben, die man als Indizes dem Symbol oder bei Atomgruppen, die in Klammern stehen, der Klammer rechts unten angefügt, z. B. Ca3(PO4)2 für Calciumphosphat, C6H7NO2S für Benzolsulfamid. Die Angabe der Anzahl der Moleküle Kristallwasser oder anderer lose gebundener Moleküle erfolgt durch vorangestellte arab. Ziffern, z. B. Na2SO4 ·10 H2O. Durch Aneinanderreihen der Symbole der am Aufbau der Verbindungen beteiligten Elemente erhält man als einfachst mögliche F. die empirische F. (Summenformel, Bruttoformel), die nur die stöchiometrische Zusammensetzung zum Ausdruck bringt, z. B. CaO4S. Besteht die Verbindung aus diskreten Molekülen ("definierte Einzelmoleküle" im Gegensatz zum Ionenkristall, wie NaCl), so gibt man die Molekülformel an, die mit der tatsächlichen relativen Molekülmasse übereinstimmt, z. B. für Dischwefeldichlorid S2Cl2 und nicht SCl. Wenn sich die relative Molekülmasse mit der Temperatur, dem Aggregatzustand o. ä. ändert, wird die empirische F. verwendet, z. B. S, P bzw. NO2 anstelle von S8, P4, N2O4, es sei denn, es soll ausdrücklich die Molekülgröße angegeben werden. Die Verknüpfung der Atome in einem Molekül und deren Anordnung im Raum wird durch die Strukturformel (Konstitutionsformel, Valenzstrichformel) angegeben. Die durch Elektronenpaare miteinander verbundenen Atome werden dabei durch Valenzstriche verknüpft. Die Strukturformel für Wasser ist H-O-H, für Schwefelsäure

In Ringstrukturen, z. B. bei Benzol, Heterocyclen, wird jede C1-Gruppe durch eine entsprechende Ringecke gekennzeichnet. Ein noch besseres Bild von den Bindungsverhältnissen innerhalb des Moleküls vermittelt die Elektronenformel. Bei dieser kennzeichnet man die Außenelektronen eines
Atoms durch Punkte, z. B. atomares Chlor![]()
Wasser![]()
. In der Strukturformel können die freien, an der Bindung nicht beteiligten Elektronenpaare als Querstriche abgebildet werden, z. B. WasserH-O---H.
Elektronenformeln ionisierter Verbindungen, z. B.![]()
, werden zur Ionenformel vereinfacht. Bei ihr werden nicht die Elektronen, sondern die Ionenladungen durch Pluszeichen oder Minuszeichen rechts oben am Elementsymbol angegeben, z. B. Na+Cl-. Weiter können die Elektronenformeln dadurch vereinfacht werden, daß man alle Elektronen und Ladungen wegläßt und Verbindungen höherer Ordnung durch eine Komplexformel kennzeichnet, z. B.
Schwefelsäure 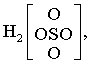
in der sich die F. des Komplex-Ions z. B. zu [SO4] zusammenfassen läßt. Die räumliche Anordnung der Atome im Molekül kann durch die Stereoformel (Stereoisomerie) ausgedrückt werden. Verstärkte Linien symbolisieren Bindungen, die oberhalb, gestrichelte Linien solche, die unterhalb der Papierebene liegen. Ausgezogene Linien normaler Strichstärke bedeuten Bindungen, die in der Papierebene liegen. Wellenlinien geben Bindungen wieder, deren Richtung unbestimmt ist. Für Monosaccharide wird die Struktur durch die Fischer-Projektion oder die Haworth-Formel beschrieben. Die Struktur kann auch durch ein Präfix, wie asym, catena, cis, fac, mer, nido, η oder μ, gekennzeichnet werden, z. B. cis-[PtCl2(NH3)2]. Polymorphe werden durch Angabe des Kristallsystems (Bravais-Gitter) mittels Pearson-Symbole unterschieden (a = triklin, c = kubisch, h = hexagonal, m = monoklin, o = orthorhombisch, t = tetragonal; P = primitives Gitter, S = basisflächenzentriertes Gitter, F = allseitig flächenzentriertes Gitter, I = raumzentriertes Gitter, R = rhomboedrisches Gitter); z. B. ZnS(h). Auch das Anhängen des Namens oder der Formel einer typischen Verbindung, z. B. TiO2(t) Anatas-Typ, AuCd (CsCl-Typ) ist möglich.
Eine allgemeine Kennzeichnung kristalliner Phasen veränderlicher Zusammensetzung (Nomenklatur, Abschn. B IX) kann durch das Zeichen ˜ (zu lesen ›zirka‹) erfolgen, das vor oder über die Formel gesetzt wird, z. B. ˜ FeS. Beruht die veränderliche Zusammensetzung einer Phase auf ganzer oder teilweiser Substitution, so werden die sich gegenseitig vertretenden Atome oder Atomgruppen gemeinsam in Klammern gesetzt und durch Komma getrennt. So bedeutet (Cu, Ni) den ganzen Bereich vom reinen Kupfer bis zum reinen Nickel. Vollständiger wird die Bezeichnungsweise, wenn in der Formel die Variablen angegeben werden, die die Zusammensetzung bestimmen. So läßt sich z. B. die homogene Phase zwischen Kupfer und Nickel durch die Bezeichnung CuxNi1-x und die zwischen LiCl und MgCl2 durch Li2-2xMgxCl2 wiedergeben. Die F. zeigen, daß die Gesamtzahl der Atome in der Elementarzelle konstant ist. Eine bestimmte Zusammensetzung der Phase kann durch Angabe des tatsächlichen Wertes von x angezeigt werden, den man in Klammern am besten unmittelbar hinter die F. setzt, z. B. Li4-xFe3xTi2(1-x)O6 (x = 0,35). Ein Platz in der Struktur oder Leerstellen (symbolisiert durch ![]()
bzw. V) und Zwischengitterplätze können dadurch beschrieben werden, daß die Symbole hinter die Atomsymbole gestellt werden, z. B. für Vanadiumcarbid, in dem 0,2 C-Lagen unbesetzt sind: CC,0.8VC,0.2VV,1. Elektronen und positive Löcher, die im Feld eines Überschusses von positiver und negativer Ladung gebunden sind, werden als e' bzw. h· bezeichnet.
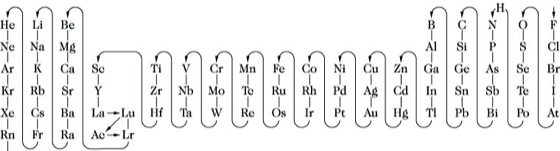
Formel. Abb.: Reihenfolge der Elemente.










Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.