Lexikon der Chemie: Grenzflächenspannung
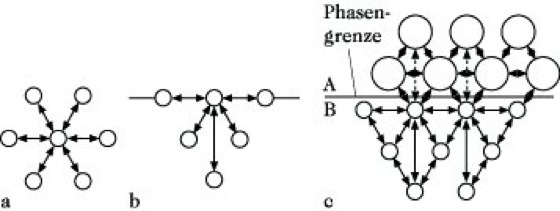
Grenzflächenspannung, spezifische freie Grenzflächenenergie, σ, die reversible Arbeit zur Vergrößerung der Grenzfläche um 1 m2. Phänomenologisch definiert entspricht das derjenigen Kraft, die an einer gedachten in der Grenzfläche befindlichen Linie von 1 m Länge wirkt. Da beide Größen dimensionsgleich sind, beträgt die Einheit der G. entweder Newton Meter-1 oder Joule Meter-2. An den Phasengrenzen flüssig/gasförmig und fest/ gasförmig bezeichnet man die G. als Oberflächenspannung. Bei der Vergrößerung der Oberfläche von Flüssigkeiten ändert sich die Zusammensetzung an der Phasengrenze nicht, bei Festkörpern dagegen muß man zwei G. unterscheiden: 1) die G. bei konstanter Zusammensetzung, die bei der Bildung fester Körper, z. B. durch Kristallisationsvorgänge, auftritt, und 2) die G. bei Veränderung der Zusammensetzung, die bei der Verformung fester Körper zustande kommt. Der Zahlenwert der G. hängt von den zwischenmolekularen Kräften zwischen den Molekülen (oder Atomen oder Ionen) des jeweiligen Stoffes ab. Im Phaseninneren werden alle Moleküle in den drei Raumrichtungen von den gleichen Wechselwirkungskräften beansprucht (Abb. a). Anders verhält es sich an der Phasengrenze. So werden z. B. die Moleküle der kondensierten Phase an der Phasengrenze in Kontakt mit der Gasphase nur mit Molekülen im Volumeninneren und an der Phasengrenze selbst wechselwirken (Abb. b).
Stoffe, zwischen deren Atomen (Molekülen) nur London-Kräfte wirken, werden deshalb nur eine niedrige G. haben, Ionenkristalle und Metalle dagegen eine hohe. An der Phasengrenze kondensierter Phasen wird die G. zwischen denen beider Phasen liegen. Die Wechselwirkung zwischen den Molekülen dieser Stoffe ist schematisch in Abb. c dargestellt. Die Wechselwirkung auf die Phasengrenzmoleküle des Stoffes A setzt sich zusammen aus der Wechselwirkungsenergie VAA der Moleküle des Stoffes A vermindert um die Energie VAB zu den Molekülen des Stoffes B. Für die Wechselwirkung auf die Phasengrenzmoleküle B ergibt sich analog VBB – VAB. Die gesamte Wechselwirkungsenergie V an der Phasengrenze zweier nicht mischbarer Flüssigkeiten beträgt demnach: V = VAA + VBB – 2 VAB. Diese Gleichung wäre ohne Schwierigkeiten lösbar, wenn alle Energieterme auf die Dispersionskräfte zurückgeführt werden könnten, was jedoch nicht zutreffend ist. Die G. von Wasser gegen Luft oder gegen mit Wasser nicht mischbare Flüssigkeiten kann durch Tenside herabgesetzt werden. Das wird in der Praxis ausgenützt, z. B. zur besseren Benetzung fester Körper, beim Waschprozeß. Auch bei der Bearbeitung fester Körper oder bei Mahlprozessen erreicht man eine Erhöhung der Effektivität durch Erniedrigung der G. (Naßmahlung). Die G. von Flüssigkeiten kann man z. B. mit der Ringmethode nach Du Noüy oder der Plattenmethode nach Wilhelmy messen. Bei der Ringmethode mißt man die maximale Kraft, die am Umfang 4πR angreift, wenn man den Ring durch die Phasengrenze zieht. Bei der Plattenmethode bringt man eine vollständig benetzbare Platte mit der Grenzfläche in Kontakt und wägt die Flüssigkeit, die am Plattenumfang angreift.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.