Lexikon der Chemie: Raoultsches Gesetz
Raoultsches Gesetz, thermodynamische Gesetzmäßigkeit, die den Partialdampfdruck pi eines Stoffes i über einer Mischung in Abhängigkeit von der Zusammensetzung der flüssigen Phase angibt: pi = p0i xi. Dabei sind p0i der Dampfdruck des Stoffes i im reinen Zustand und xi der Molenbruch in der Flüssigkeit. In dieser Form ist das R. G. ein Grenzgesetz, das nur für ideale Mischungen oder näherungsweise in starker Verdünnung gilt. Treten in der Mischung Wechselwirkungen zwischen den verschiedenen Teilchen auf, die anders sind als die im reinen Stoff (reale Mischung), muß anstelle des Molenbruches die Aktivitätai = fixi verwendet werden, wobei fi der Aktivitätskoeffizient ist. Das R. G. lautet dann pi = p0i ai = p0i xi fi. Überwiegen die Anziehungskräfte, dann ist der Partialdruck niedriger als im Idealfall und fi< 1. Dominieren die Abstoßungskräfte, wird die Flüchtigkeit erhöht (fi > 1).
Anwendungen des R. G. 1) Besteht die Mischung aus zwei flüchtigen Komponenten 1 und 2, so ist der Gesamtdampfdruck p über der Mischung nach dem Daltonschen Gesetz gleich der Summe der Partialdrücke p1 und p2 gemäß p = p1 + p2. Im Idealfall gilt für beide Partialdrücke das R. G. in der Form p1 = p01x1 und p2 = p02x2.
2) Enthält die binäre Mischung einen Stoff 2 ohne merklichen Dampfdruck, dann spricht man häufig von Lösungen, bezeichnet diesen Stoff 2 als den gelösten Stoff, den Stoff 1 als Lösungsmittel. Dann gilt im Idealfall für den Gesamtdruck p = p1 = p01x1 = p01 (1 – x2), da p2 = 0. Der Dampfdruck p über der Lösung ist also geringer als der des reinen Lösungsmittels p01. Es folgt x2 = (p01 – p)/p01, wobei der Ausdruck (p01 – p)/p01 als relative Dampfdruckerniedrigung bezeichnet wird. Die Absenkung der Dampfdruckkurve hat zwangsläufig eine Gefrierpunktserniedrigung und Siedepunktserhöhung zur Folge (Abb.). Drückt man die aus der Dampfdruckerniedrigung Δp folgende Verschiebung dieser beiden Fixpunkte um ΔT mit Hilfe der Clausius-Clapeyronschen Gleichung aus, folgt das 2. R. G. ΔT = km2 mit k = RT2M1/ΔpH. Dabei bedeuten R die allgemeine Gaskonstante, M1 die Molmasse des Lösungsmittels, T seine Erstarrungs- bzw. Siedetemperatur, ΔpH die zugehörige molare Phasenumwandlungsenthalpie, m2 die molare Konzentration des Stoffes 2. k wird als kryoskopischeKonstante bzw. ebullioskopische Konstante bezeichnet. Die beiden speziellen Formen des R. G. stellen Grenzgesetze für ideal verd. Lösungen dar. Abweichungen vom idealen Verhalten können auch hier durch die Einführung der Aktivitätskoeffizienten korrigiert werden.
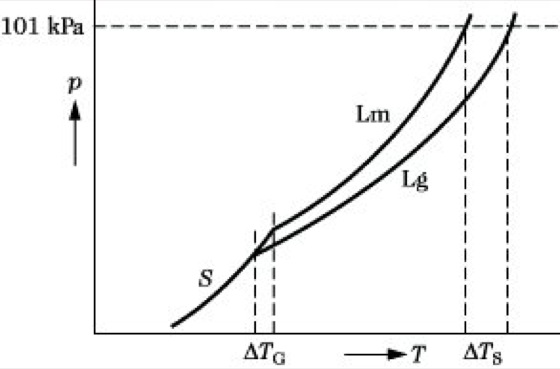
Raoultsches Gesetz. Abb.: Auswirkung der Dampfdruckerniedrigung auf den Schmelz- und Siedepunkt einer Lösung (schematisch). Lm Dampfdruckkurve des reinen Lösungsmittels, Lg Dampfdruckkurve der Lösung, S Sublimationskurve des festen Lösungsmittels, ΔTS Siedepunktserhöhung, ΔTG Gefrierpunktserniedrigung.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.