Lexikon der Chemie: Stöchiometrie
Stöchiometrie, die Lehre von der Berechnung der Zusammensetzung chem. Verbindungen und Mischungen sowie der Massen-, Volumen- und Ladungsverhältnisse bei chem. Reaktionen. Die Herausbildung der S. war eine wichtige Voraussetzung für die Entwicklung der Chemie zu einer exakten Wissenschaft.
Die S. basiert auf der gesicherten Erfahrung, daß bei chem. Reaktionen die chem. Elemente vollständig erhalten bleiben (Gesetz von der Erhaltung der Elemente) und die Gesamtmasse der beteiligten Substanzen konstant ist (Gesetz von der Erhaltung der Masse). Zu den eigentlichen stöchiometrischen Grundgesetzen zählen die Gesetze der stöch. Proportionen, das chem Volumengesetz von Gay-Lussac. und das Avogadrosche Gesetz. Die Grundlage für die S. von elektrochem. Vorgängen bilden die Faradayschen Gesetze, zur stöch. Berechnung von Reaktionen, an denen Gase beteiligt sind, wird die Zustandsgleichung idealer Gase benötigt.
Anwendungen. Die Anwendung der S. auf Mischungen bzw. Lösungen schließt den Umgang mit Zusammensetzungsgrößen ein. Die Durchführung stöch. Berechnungen ist in nahezu allen Teilgebieten der Chemie erforderlich. Dabei sind folgende Anwendungsfälle am häufigsten.
1) S. der Zusammensetzung von Verbindungen. Die Grundlage bilden hier die die Größen Masse m, molare Masse M und Stoffmenge n verknüpfende Gleichung M = m/n sowie die Feststellung, daß die Stöchiometriezahlen νi in einer Formel Stoffmengenverhältnisse angeben. So gilt z. B. für Fe2O3nFe : nO = νFe : νO = 2 : 3. Typische Aufgabenstellungen sind die Berechnung der Massenanteile w der einzelnen Elemente in einer Verbindung aus der Substanzformel oder die Ermittlung der Substanzformel aus den experimentell bestimmten Massenanteilen der Elemente (Elementaranalyse).
2) S. von chemischen Reaktionen. Die Berechnung des Stoffumsatzes bei chem. Reaktionen geht von der entsprechenden Reaktionsgleichung (Stoffgleichung) aus, die die stöch. Verhältnisse zwischen den Ausgangs- und Endstoffen beschreibt. Die Gleichung N2 + 3 H2 → 2 NH3 gibt für den molekularen Bereich den elementaren Formelumsatz (Reaktion von einem N2-Molekül mit drei H2-Molekülen zu zwei NH3-Molekülen) an und drückt gleichzeitig für den makroskopisch-stofflichen Bereich den molaren Formelumsatz (1 mol = 28,0 g N2 reagiert mit 3 mol = 6,0 g H2 zu 2 mol = 34,0 g NH3) aus. Über die Beziehung m = nM kann die Umrechnung der Stoffmengen in Massen erfolgen.
Als Ausbeute einer Reaktion bezeichnet man den Quotienten aus praktisch erhaltener und theoretisch möglicher (d. h. bei vollständigem Ablauf der Reaktion gemäß ihrer S. berechneter) Menge an Endprodukt(en).
3) Herstellen, Verdünnen und Mischen von Lösungen. Lösungen bestimmter Zusammensetzung und Menge können entweder durch Auflösen der entsprechenden Substanz(en) im reinen Lösungsmittel, durch Lösungsmittelzusatz zu einer konzentrierteren Lösung (Verdünnung) oder durch Zusammengeben von Lösungen höherer und niederer Konzentration als der gewünschten (Mischen) hergestellt werden. Die stöch. Berechnungen für diese drei Methoden gehen von der Definitionsgleichung für die jeweils benutzte Zusammensetzungsgröße sowie in sehr vielen Fällen von der Beziehung m = nM aus. Beim Herstellen einer Lösung durch unmittelbares Auflösen wird die benötigte Menge der zu lösenden Substanz meist durch Wägung abgemessen. Beim Verdünnen konzentrierterer Lösungen bleiben die Stoffmenge n bzw. die Masse m der gelösten Substanz unverändert. Bezeichnet der Index 1 den Zustand vor, der Index 2 den Zustand nach dem Verdünnen, so gilt n1 = n2 und m1 = m2. Für die Stoffmengenkonzentration c bzw. den Massenanteil w gelten die für alle Verdünnungsberechnungen grundlegenden Beziehungen c1V1 = c2V2 und w1m1 = w2m2.
Für das Mischen mehrerer Lösungen (Index i) der gleichen Substanz, aber von unterschiedlicher Konzentration, gilt als Grundsatz, daß die gesamte Menge der gelösten Substanz in der Mischung (Index M) vorhanden ist: ![]()
. Die davon abgeleiteten Beziehungen ![]()
und ![]()
werden als Mischungsgleichungen bezeichnet.
4) Anwendung der S. in der quantitativen chem. Analyse. Im Falle der Gravimetrie wird der zu bestimmende Anteil durch geeignete Reaktionen und Operationen in eine stöch. wohldefinierte Wägeform AνA BνB übergeführt und deren Masse m(AνA BνB) durch Wägung bestimmt. Die in der Probe enthaltene Masse m(A) des Bestandteils A mit der Molmasse M(A) läßt sich nach
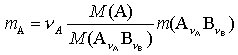
berechnen. In dieser Gleichung sind für eine gegebene gravimetrische Bestimmung die Stöchiometriezahl νA und die beiden Molmassen konstante Größen, die zum gravimetrischen Faktor fgrav. dieser Methode zusammengefaßt werden. Die Kenntnis der gravimetrischen Faktoren erleichtert die analytische Routinearbeit, sie sind deshalb für alle wichtigen gravimetrischen Bestimmungen in Tabellenwerken und Lehrbüchern der analytischen Chemie zusammengestellt.
In der Volumetrie geht die stöch. Auswertung einer Titration davon aus, daß bei Erreichen des Äquivalenzpunktes äquivalente Stoffmengen nev = nz von Titrand (Index 1) und Titrator (Index 2) miteinander reagiert haben: nev,1 = nev,2 = n1z1 = n2z2. Hierbei bedeutet z stöchiometrische Wertigkeit. Da für den Zusammenhang zwischen Stoffmenge n, Stoffmengenkonzentration c und Volumen V die Gleichung c = n/V gilt, ermöglicht die Kenntnis von c2 und V2 der verbrauchten Maßlösung die Berechnung des Titrandgehaltes der Probelösung: c1 = (c2z2V2)/(z1V1). Für die Masse an Titrand ergibt sich daraus m1 = (M1c2z2V2)/z1. Meist verwendet man den Titrator in Form einer Normallösung, deren Äquivalenzkonzentration nev,2 = n2z2 beträgt. Für eine gegebene titrimetrische Bestimmung und eine bestimmte Normalität der Maßlösung sind M1, z1 und c2 konstante Größen, die zum titrimetrischen Faktor ftitr. = M1c2/z1 zusammengefaßt werden können. Die titrimetrischen Faktoren (bisweilen auch als maßanalytische Äquivalente bezeichnet) liegen gleichfalls für wichtige maßanalytische Bestimmungen tabelliert vor. Abweichungen der Maßlösung von der angestrebten Standardnormalität (meist 0,1 N oder 0,01 N) werden bei der stöch. Auswertung dadurch berücksichtigt, daß man V2 mit einem Korrekturfaktor, dem experimentell ermittelten Faktor F der Maßlösung, der auch als Titer bezeichnet wird, multipliziert.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.