Lexikon der Chemie: Zinnchloride
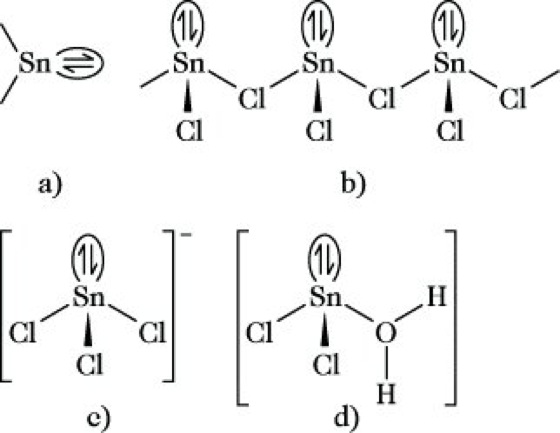
Zinnchloride. Zinn(II)-chlorid, Zinndichlorid, SnCl2 farblose, in Wasser, Alkohol, Ether und anderen organischen Lösungsmitteln lösliche, rhombische Kristallmasse, D. 3,95 g cm-3, F. 246 °C, Kp. 652 °C. Aus wäßriger Lösung kristallisiert SnCl2 als monoklines Dihydrat SnCl2·2 H2O (Zinnsalz). Das SnCl2-Molekül (Abb.) hat ein Elektronensextett und ist im Gaszustand erwartungsgemäß gewinkelt (a). Die Elektronenmangelsituation wird im festen Salz durch Bildung polymerer [SnCl2]n-Ketten (b) überwunden. Aus gleicher Sicht ist seine Fähigkeit zu verstehen, weitere Chlorid-Ionen zu pyramidalen [SnCl3]--Anionen (c) anzulagern. Auch die Struktur des Dihydrats, in dem ein H2O direkt an das Sn gebunden ist (d), während das zweite H2O echtes Kristallwasser darstellt und leicht abgetrennt werden kann, ist mit der Vorstellung einer bevorzugten Dreifachkoordination am Sn-II in Übereinstimmung.
SnCl2 ist ein starkes Reduktionsmittel, das z. B. Fe3+ zu Fe2+, Chromat zu Cr3+, Permanganat zu Mn2+, Arsenat zu As3+ und Au3+, Ag+ und Hg2+ zu den Metallen reduziert. Im Laboratorium ist es ein vielseitig eingesetztes Reduktionsmittel.
Zinn(IV)-chlorid, Zinntetrachlorid, SnCl4, farblose, an der Luft rauchende Flüssigkeit, D. 2,226 g cm-3, F. -33 °C, Kp. 114,1 °C. SnCl4 ist bedeutend weniger hydrolyseempfindlich als Siliciumtetrachlorid. Es löst sich in Wasser und kristallisiert aus dieser Lösung als Pentahydrat SnCl2·5 H2O (Zinnbutter). In salzsaurer Lösung addiert es zwei Moleküle Salzsäure zu Hexachlorozinnsäure H2SnCl6, die als Hexahydrat isoliert werden kann und Salze, Hexachlorostannate, der Zusammensetzung M2I[SnCl6] bildet (z. B. das auch als Pinksalz bezeichnete farblose, wasserlösliche Ammoniumsalz, (NH4)2[SnCl6], welches in der Färberei als Beize dient). Zur Herstellung läßt man Chlor auf Zinn einwirken. SnCl2 wird vor allem als Katalysator bei Chlorierungen und Kondensationsreaktionen verwendet. Außerdem ist es Basismaterial zur Synthese von zinnorganischen Verbindungen.




Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.