Lexikon der Chemie: Cycloalkane
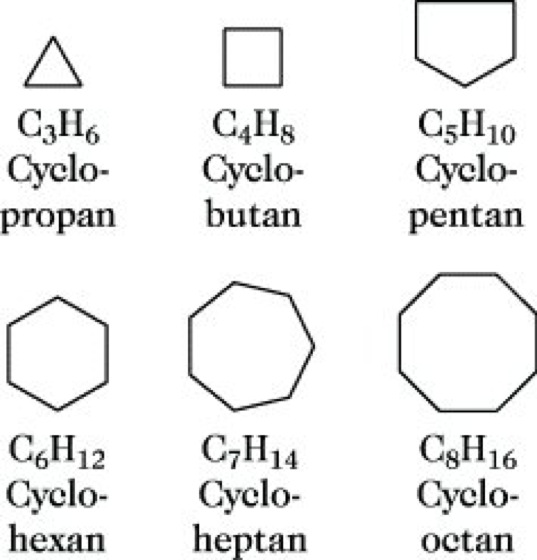
Cycloalkane, Cycloparaffine, gesättigte cyclische Kohlenwasserstoffe der allg. Formel CnH2n. C. sind in Analogie zu den Alkanen aus sp3-hybridisierten C-Atomen aufgebaut. Sie bilden eine homologe Reihe von Verbindungen unterschiedlicher Ringgröße (Abb. 1), beginnend mit Cyclopropan. Besondere Bedeutung haben Cyclopentan und Cyclohexan als Kohlenstoffgerüste in natürlich vorkommenden Ringsystemen, z. B. Terpene oder Steroide, bzw. in technisch wichtigen Produkten, z. B. Naphthene.
Die Bezeichnung erfolgt durch Kombination der Vorsilbe Cyclo- mit dem Namen des geradkettigen Alkans gleicher Anzahl von C-Atomen.
Eigenschaften. Die C. zeigen Ähnlichkeiten mit den Alkanen, jedoch unterscheiden sich die C. untereinander sehr stark hinsichtlich ihrer Stabilität in Abhängigkeit von der Ringgröße. Cyclopropan und -butan sind stark gespannte Ringsysteme mit geringer Bildungstendenz und beachtlicher Ringöffnungstendenz bei chemischen Reaktionen. Sie weisen eine hohe Spannungsenergie auf (115,5 bzw. 109,6 kJ mol-1), die auf eine starke Abweichung der Bindungswinkel vom Tetraederwinkel zurückzuführen ist. Die vom Drei- zum Vierring abnehmende Ringspannung wird als Bindungswinkel- oder Baeyer-Spannung bezeichnet (Baeyersche Spannungstheorie). Bei Cyclopentan, -hexan und -heptan nimmt die Spannungsenergie sprunghaft ab (C5H10: 27,2; C6H12: 0; C7H14: 25,9 kJ mol-1), da nur geringe oder keine Abweichungen vom Tetraederwinkel eintreten. Die trotzdem beobachteten geringen Ringspannungen werden durch die Torsions- oder Pitzer-Spannung (Stereoisomerie) hervorgerufen. Die erneut deutlich höheren Spannungsenergien von etwa 42 bis 53 kJ mol-1 bei den Homologen C8 bis C11 beruhen auf Bindungswinkel- und Torsionsspannungen sowie zusätzlich transannularen Wechselwirkungen. Große Ringe ab C12 sind nahezu spannungsfrei und in ihren Eigenschaften den langkettigen Alkanen sehr ähnlich. Aus den genannten Gründen teilt man die C. ein in kleine Ringe (3 bzw. 4 C-Atome) mit geringer Stabilität und Bildungstendenz, normale Ringe (5 bis 7 C-Atome mit relativ großer Stabilität und Bildungstendenz, mittlere Ringe (8 bis 11 C-Atome), vergleichbar mit den kleinen Ringen, und große Ringe (12 und mehr C-Atome), die hohe Stabilität und Bildungstendenz aufweisen.
gibt eine analoge Reaktion bei höherer Temperatur, wobei Butan entsteht. Cyclopropan reagiert auch mit Bromwasserstoff und mit Brom unter Ringöffnung zu Brompropanderivaten: C3H6 + HBr → CH3-CH2-CH2-Br (1-Brompropan); C3H6 + Br2 → Br-CH2-CH2-CH2-Br (1,3-Dibrompropan). Cyclobutan ergibt mit diesen Reagenzien unter gleichen Bedingungen keine Reaktion. Charakteristisch für viele C. sind Umlagerungen unter Ringerweiterung oder Ringverengung. So läßt sich z. B. Ethylcyclobutan mit Aluminiumchlorid unter Erwärmen in Methylcyclopentan oder Cycloheptan in Methylcyclohexan überführen.
Cycloalkane. Abb. 2: Cyclisierungsreaktionen.
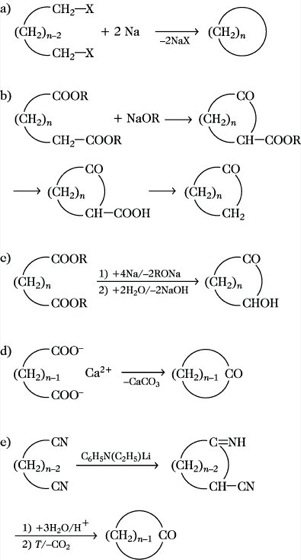
Herstellung. Für kleinere und mittlere Ringe sind besondere Methoden erforderlich, z. B. das Ruggli-Zieglersche Verdünnungsprinzip. Bei Ringschlußreaktionen werden als Konkurrenzreaktion auch intermolekulare Umsetzungen beobachtet, die zu Polymeren führen. Die Ausbeuten schwanken deshalb und sind von der unterschiedlichen Ringbildungstendenz abhängig. Folgende Cyclisierungsreaktionen eignen sich für die Synthese von C. und ihren Derivaten:
- Intramolekulare Wurtz-Reaktion (Abb. 2 a) von α,ω-Dihalogenalkanen für C. der Ringgrößen n = 3 bis n = 6.
- Dieckmann-Kondensation (Abb. 2 b) von Dicarbonsäureestern zu Cycloketonen C5 bis C7, die weiter zu C. reduzierbar sind.
- Acyloinreduktion (Abb. 2 c) von Dicarbonsäureestern für große und mittlere Ringe, wobei das Verdünnungsprinzip nicht erforderlich ist. Die Acyloine lassen sich ebenfalls bei Bedarf reduzieren.
- Pyrolyse (Abb. 2 d) von Calcium-, Barium- oder Thoriumsalzen von Dicarbonsäuren zu Cycloketonen der Ringgrößen n = 5, 6, 7 sowie ab n = 12 aufwärts.
- Intramolekulare Thorpe-Reaktion (Abb. 2 e) von Dinitrilen zu Cycloketonen unter Anwendung des Verdünnungsprinzips für 5- bis 8- und 14- bis 33-gliedrige Ringe.
Neben diesen Synthesemethoden haben Ringerweiterungsreaktionen und Ringverengungsreaktionen sowie Cycloadditionsreaktionen verschiedener Typen Bedeutung. Ausgehend von cyclischen Ausgangsstoffen sind die besprochenen Darstellungsmethoden auch zur Gewinnung von Bi- und Tricycloalkanen sowie höher kondensierter Ringsysteme anwendbar.
Im Gegensatz zu n-Alkanen (Alkanabbau) werden C. nur von wenigen Mikroorganismen als einzige C- und N-Quelle verwertet. Für Acinetobacter sp. (z. B. NCIB 9871) wird ein Abbau von Cyclohexan über Cyclohexanol, Cyclohexanon, 1-Oxo-2-oxocaprolacton vorgeschlagen, welches nach Ringspaltung über 6-Hydroxyhexansäure und 6-Oxohexansäure in Adipinsäure umgewandelt wird. Vor allem die einleitende Oxygenierung des Cyclohexanringes kann nur von wenigen Mikroorganismen durchgeführt werden. Die gebildete Adipinsäure wird zu Acetyl-CoA und Succinyl-CoA abgebaut, die in zentrale Stoffwechselwege einmünden.
Auch n-alkylsubstituierte Cyclohexane werden durch Mikroorganismen abgebaut. Nach terminaler Oxidation der Alkankette und anschließender β-Oxidation entsteht bei geradzahligen Alkanen Cyclohexanessigsäure, bei ungeradzahligen Cyclohexancarbonsäure. Durch das Zusammenwirken verschiedener Bakterien (z. B. Arthrobacter, Corynebacterium, Pseudomonas) kann diese über eine Aromatisierung abgebaut werden. Die gebildete Protocatechusäure wird nach ortho- oder meta-Spaltung weiter metabolisiert (aromatische Kohlenwasserstoffe)
Durch Cometabolismus bzw. Cooxidation kann das Verwertungsspektrum der mikrobiell umsetzbaren C. beträchtlich erweitert werden.






Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.