Lexikon der Chemie: Mesomerie
Mesomerie, nach L. Pauling auch als Resonanz bezeichnet, eine von Robinson und Ingold (1926) bzw. Arndt und Eistert (1924) unabhängig voneinander entwickelte Lehre zur Beschreibung der Bindungsverhältnisse in Molekülen, für die eine Zuordnung von einsamen und bindenden Valenzelektronenpaaren durch eine Valenzstrichformel nicht in befriedigender Weise möglich ist. Der Grundzustand dieser Moleküle wird durch Überlagerung der angebbaren Valenzstrichformeln (mesomere Grenzstrukturen, Valenzstrukturen) beschrieben. Die Grenzstrukturen stellen keine real existierenden Zustände des Moleküls dar, sondern dienen lediglich als Hilfsmittel, um die wirkliche Elektronenstruktur zu veranschaulichen. Die Überlagerung der Grenzstrukturen wird durch den Mesomeriepfeil (≈) zum Ausdruck gebracht. Die Mesomerielehre dient besonders zur Erklärung der Bindungsverhältnisse von Molekülen mit konjugierten Doppelbindungen, speziell aromatischer Verbindungen, z. B. Benzol. Für das Benzolmolekül können neben den beiden Kekulé-Strukturen K1 und K2 noch drei Dewar-Strukturen D1, D2 und D3 als wesentliche Grenzstrukturen angegeben werden (Abb.). Durch die Überlagerung der Grenzstrukturen wird die Delokalisierung der 6 π-Elektronen im Benzol über das gesamte Molekül ausgedrückt. Der damit verbundene Ausgleich der C-C-Bindungslängen (140 pm) wird durch experimentelle Befunde bestätigt. Dieser Wert liegt zwischen dem einer Einfachbindung (154 pm) und einer isolierten Doppelbindung (133 pm). Die Delokalisierung und der Bindungslängenausgleich werden formelmäßig oft so wiedergegeben, daß anstelle der Doppelbindungen ein Kreis in das Sechseck gezeichnet wird (Abb.). Die quantenmechanische Behandlung der Überlagerung von Grenzstrukturen (Valenzstrukturtheorie) zeigt, daß die Energie des mesomeren Systems gegenüber den Energien der fiktiven Grenzstrukturen erniedrigt ist (Abb.). Man erkennt, daß die energiereicheren Dewar-Strukturen nur noch wenig zur Energieerniedrigung beitragen. Die Differenz der Energie des tatsächlichen Grundzustandes des Moleküls und der energieärmsten Grenzstruktur wird als Mesomerieenergie (Resonanzenergie) bezeichnet. Sie kann näherungsweise auch experimentell bestimmt werden, indem man die wirkliche Energie des Moleküls aus den Verbrennungs- oder Hydrierungswärmen ermittelt und davon den nach dem Additivitätsprinzip berechneten hypothetischen Energieinhalt der energieärmsten Grenzstruktur subtrahiert. Grenzstrukturen sind lediglich durch Verschiebung von Valenzelektronenpaaren ineinander überführbar. Bei Molekülen mit konjugierten Doppelbindungen ist eine maximale Mesomeriestabilisierung aufgrund der Überlappung (Molekülorbitaltheorie) der π-Orbitale nur möglich, wenn ein ebenes σ-Bindungsgerüst vorliegt. Mit zunehmender Abweichung von der Koplanarität nimmt die Mesomerieenergie ab. (Koplanarität bedeutet, daß alle Atome in einer Ebene liegen.) Da mesomere Grenzstrukturen nur hypothetische Hilfsmittel zur Beschreibung des wahren Molekülzustandes darstellen, ist die M. streng von der Tautomerie zu unterscheiden, bei der ein echtes Gleichgewicht zwischen zwei strukturell unterschiedlichen Molekülformen vorliegt.
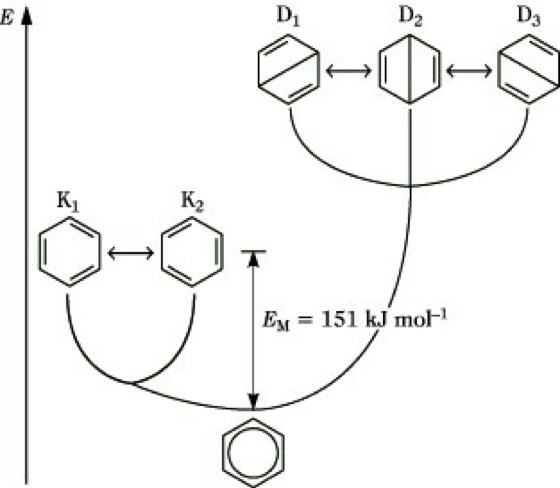
Mesomerieenergie. Abb.: Mesomerieenergie des Benzols.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.