Gentherapie: Bereit zum Abheben

Die Entwicklungen auf dem Gebiet der Gentherapie erinnern in vielerlei Hinsicht an das einstige Aufstreben der Luftfahrt. Beide stehen und fallen zunächst einmal mit einem erstaunlich simplen Grundprinzip: Dem Einbringen eines therapeutischen Gens in Zellen auf der einen Seite – dem Luftstrom über dem Flugzeugflügel auf der anderen. Und bei beiden liegt der Teufel anschließend im Detail; oder besser: in vielen, vielen Details. Beide Konzepte hatten ganz von Anfang an mit Rück- und Fehlschlägen zu kämpfen. Und doch sind beide, allen pessimistischen Prognosen zum Trotz, weiterverfolgt worden. Und mittlerweile glauben Mediziner fest daran, dass die Gentherapie für die Medizin werden kann, was das Flugzeug für das Transportwesen wurde.
Befeuert wird der Optimismus jetzt durch zwei neue Studien [1, 2]. In beiden hatten Forscher sich das Lentivirus als Transduktions-Vektor zu nutze gemacht – und damit eine Methode, die immer stärkere Bedeutung für den Erfolg der Gentherapie zu gewinnen scheint [3]. Im Rahmen der Technik ernten Mediziner dabei zunächst einen bestimmten Stammzelltyp aus dem Körper der Patienten und fügen ein therapeutisches Gen hinzu, wobei sie sich eines Übertragungssystems (also eines Vektors) bedienen, das auf unbedenkliche Weise aus den Einzelteilen von HI-Viren zusammengebaut wird. Schließlich injizieren sie das modifizierte Zellkonstrukt wieder in den Körper zurück.
Die ersten länderübergreifenden Gentherapie-Tests mit lentiviralen Vektoren gegen Erbkrankheiten waren in Frankreich durchgeführt worden, um Patienten mit Adrenoleukodystrophie [4] sowie Beta-Thalassämie [5] zu behandeln. Schon sie konnten den Hinweis liefern, dass der Ansatz über einen Zeitraum von sechs Jahren hinweg bei einigen Patienten klinisch effizient arbeiten kann. Die beiden neuen Studien steuern nun Resultate von zwei weiteren Versuchen bei, die erneut Verbesserungen belegen – in einer wurde die Metachromatische Leukodystrophie, im anderen das Wiskott-Aldrich-Syndrom bekämpft.
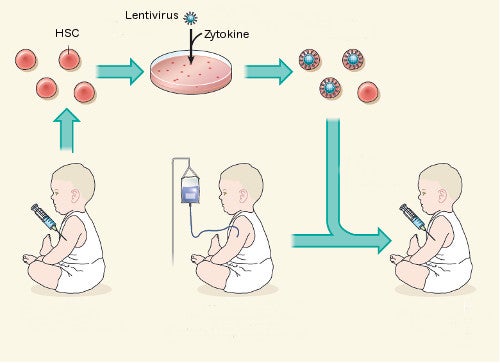
(Ausschnitt)
- 1Patient mit Erbkrankheit
- 2Stammzellen werden therapiert, kranke Zellen im Körper abgetötet
- 3Reparierte Stammzellen werden gespritzt und ersetzen defekte Vorgänger
Die MLD ist eine durch den Ausfall des Enzyms Arylsulphatase A (ARSA) hervorgerufene Erbkrankheit. Im Nervensystem von Betroffenen sammelt sich nach und nach ein giftiges Stoffwechselprodukt an, was schließlich zu ernsthaften kognitiven Störungen und motorischen Ausfallerscheinungen führt. Kinder, die an der schweren Form der Krankheit namens MLD-LI leiden, sterben einige Jahre nach dem Aufkommen der ersten Symptome. Die derzeitigen Behandlungsversuche sind oft wenig wirksam.
Die Forscher um Alessandra Biffi vom San Raffaele Scientific Institute in Mailand haben zunächst blutbildende Zellen – die so genannten hämatopoetischen Stammzellen (HSC) – aus dem Knochenmark von drei an MLD-LI erkrankten Kindern extrahiert, die bis zu diesem Zeitpunkt noch keine Krankheitssymptome gezeigt hatten. Diese Zellen setzten sie dann einem ARSA-exprimierenden Lentivirus aus. Die transduzierten Zellen injizierten sie schließlich wieder den Kindern, die unterdessen eine kurzfristige Chemotherapie durchlaufen mussten, bei der die natürlichen, nicht therapierten HSC ihres Körpers vollständig zerstört wurden. Mediziner kennen dieses Prozedere als Transplantation mit myeloablativer Konditionierung (siehe Grafik). Die Studienleiter hatten vermutet, dass die Blutzellen das fehlende Enzym nun in unphysiologisch großen Mengen produzieren würden – schließlich waren im Lentivirus-Vektor spezielle Enhancer- und Promotorsequenzen integriert, die für eine verstärkte Expression von ARSA sorgen sollten. Das sollte im Endeffekt dazu führen, das im Nervensystem direkt oder indirekt ausreichende Mengen des fehlenden Enzyms anfallen sollten, um einen therapeutischen Effekt zu erzielen.
Tatsächlich übertrafen die Ergebnisse alle Erwartungen. Noch zwei Jahre nach der Therapie trugen mehr als 60 Prozent der Blutzellen den Vektor, und dies oft in mehrfacher Kopie, und die ARSA-Pegel überstiegen den in gesunden Patienten üblichen Wert um das zehnfache. Solche überphysiologischen Werte sind im Sinne einer optimierten Wirksamkeit gewünscht und gelten als unbedenklich. Die Forscher fanden ARSA auch in der Zerebrospinal-Flüssigkeit. Die Krankheit schritt indes innerhalb eines Zeitraums von 7 bis 21 Monaten, nachdem die ersten Symptome beobachtet worden waren, in keinem der drei Patienten weiter fort.
Auch beim Wiskott-Aldrich-Syndrom handelt es sich um eine vererbbare Krankheit, bei dem der Gendefekt eine Immundefizienz nach sich zieht. Das Forscherteam um Alessandro Aiuti – ebenfalls vom Mailänder San Raffaele Scientific Institute – und seine Kollegen untersuchte sie an drei Kindern und verfolgte einen ähnlichen Therapieansatz wie Biffis Gruppe. Allerdings durchliefen ihre Zellen ein leicht verändertes Vorbereitungsprozedere: Weil die korrigierten HSC von Patienten ohnehin einen Selektionsvorteil gegenüber den kranken Varianten zeigen, konnte die Myeloablation in abgeschwächter Form durchgeführt werden. Gleichzeitig wurden die immunsuppressiven Maßnahmen verstärkt, um die Einnistung der gentechnisch veränderten, immunokompetenten Zellen zu optimieren.
Auch Aiuti und seine Kollegen beobachteten bei allen drei Patienten mit 25 bis 50 Prozent hohe Anteile von Lentivirus exprimierenden Blutzellen. Eine exakte quantitative Bewertung des Erfolges ist schwierig – die vorbereitenden Maßnahmen spielen dort ebenso hinein wie eine nicht vernachlässigbare In-Vivo-Auslese –, jedenfalls aber ist die klinische Reaktion eindrucksvoll und deutlich stärker als bei früheren Gentherapie-Ansätzen zur Bekämpfung des Wiskott-Aldrich-Syndroms [6].
Was hat diese auffälligen Fortschritte möglich gemacht? Ein Grund liegt in der unübertroffenen Vielseitigkeit der lentiviralen Vektoren: Sie transduzieren ruhende HSC sehr effektiv, sind kompatibel mit sehr großen und komplexen therapeutischen Genkonstrukten sowie sehr effizient aufzureinigen und hochzukonzentrieren, was ihre Wirksamkeit sehr erhöht. Zudem können sie einfach tiefgekühlt gelagert werden. Am Ende aber, meinen die Forscher selbst, ist alles womöglich nur eine Frage der Dosis: Viel hilft viel.
Denn die Anzahl von Vektorkopien im Blut der Patienten des MLD-Experiments war nach der Einnistung etwa fünfmal höher als bei früheren Studien zur Therapie der Adrenoleukodystrophie oder der Beta-Thalassämie (hier fanden sich nach sechs Jahren rund 0,2 Kopien, wie sich aus meinen eigenen unpublizierten Daten herausrechnen lässt). Darüber hinaus dürften die neuen Studien auch davon profitiert haben, dass die Vektoren nach dem Aufkonzentrieren noch besser gereinigt werden konnten: Die störende Kontamination mit defekten Vektorpartikeln wurde so wohl eingeschränkt. Außerdem dürfte es sich auch ausgezahlt haben, die Viruspartikel nicht erst tiefgefrorenen zu lagern, sondern sie direkt zu spritzen – dies minimiert die Belastung der HSCs vor der Einnistung. Ein weiterer Pluspunkt mag das sehr junge Alter der Patienten gewesen sein (die MLD-Studie wurde mit 7 bis 16 Monate alten Kindern durchgeführt, die Beta-Thalassämiestudie mit 18-Jährigen). Zudem könnte die hohe Dosis der zugeführten Zellen von Vorteil gewesen sein.
Und die Risiken und Nebenwirkungen? Vor allem ein kritischer Punkt muss bei der HSC-Gentherapie immer mitgedacht werden: Es ist nicht ausgeschlossen, dass ein zufällig ins Erbgut des Wirtes integrierter Vektor Krebsgene zu aktivieren vermag; und noch liegt es nicht in der Hand der Forscher, den Ort der Integration der Lentiviren auf nicht krebsanfällige Regionen einzugrenzen. Biffis sowie Aiutis Team schöpfen allerdings Zuversicht aus ihrem querschnittartigen Monitoring der behandelten Blutzellen: Die Vektoren integrieren sich demnach breit gestreut an verschiedenen Stellen der Chromosomen, ohne dass dies zu einem prä-malignen Wuchern der HSC oder der Blutzellklone geführt hat.
Dabei bleibt festzuhalten, dass die Aussagekraft solcher Analysen noch umstritten ist – sie können fälschlicherweise sowohl beruhigen als auch alarmieren. Ein Beispiel: Der Integrationsort im Gen HMGA2 einer dominierenden Zellklonvariante bei einem Beta-Thalassämiepatienten erschien anfangs besorgniserregend – womöglich konnte dadurch eine Tumorentstehung befördert werden [5]. Sechs Jahre nach der Gentherapie zeigte sich aber, dass dieser Klon gar nicht länger besonders häufig war – und gleichzeitig die Vektorkopienzahl in den Zellen des Patienten und die Produktion des korrigierten Gens für Beta-Globin ausreichend hoch blieb, um die üblicherweise notwendige zusätzliche Bluttransfusion überflüssig zu machen, wie meine unpublizierten Daten belegen. HMGA2 hat sich mittlerweile in mehrereren Studien als Vektor-Integrationsort herausgestellt, auch bei der aktuellen Studie des Wiskott-Aldrich-Syndroms.
Jetzt sollten die Pharmaunternehmen den Staffelstab übernehmen – und die Gentherapie für den Patienten weiterentwickeln. Natürlich lassen sich auch pessimistische Stimmen vernehmen, die dem Therapieansatz zu hohe Kosten attestieren, um Patienten überall auf der Welt wirklich einmal nützen zu können. Vergleicht man aber die enormen Kosten einer lebenslang notwendigen Enzymersatztherapie oder auch einer andauernden Behandlung mit simpleren, kleinmolekularen Wirkstoffen, so wird eines deutlich: Gentherapien können – wenn sie mit Bedacht nicht übertrieben teuer angeboten werden – sowohl für Patienten wie auch für die Pharmaindustrie oder institutionelle Geldgeber attraktiv sein – und das sogar in Entwicklungsländern.
Der Artikel erschien unter dem Titel "Gene therapy: Primed for take-off" in Nature.





Schreiben Sie uns!
2 Beiträge anzeigen