Lexikon der Chemie: Wasser
Wasser, H2O, Oxid des Wasserstoffs; D. des festen W. bei 0 °C 0,9168 g cm-3, D. des flüssigen W. bei 0 °C 0,99987 g cm-3, bei 4 °C 1,0000 g cm-3, bei 20 °C 0,99823 g cm-3, F. (bei 101,3 kPa) 0,00 °C, Kp. (bei 101,3 kPa) 100,00 °C, nD20 1,3330, krit. Temp. 374,1 °C, krit. Druck 22,05 MPa, krit. D. 0,3155 g cm-3, Schmelzenthalpie 6,010 kJ/mol, Verdampfungsenthalpie bei 100 °C 40,651 kJ/mol, Bildungsenthalpie -2136,02 kJ/mol, spezifische Wärme bei 15 °C 4,1868 J/gK, Viskosität bei 20 °C 1,0026·10-3 Pa · s, Oberflächenspannung bei 20 °C 72,75·10-1 N/m, Dielektrizitätskonstante bei 18 °C 80,84, elektrische Leitfähigkeit bei 0 °C 6,35·10-12 Sm/mm2.
Eigenschaften. W. ist eine farblose, geruch- und geschmacklose Flüssigkeit, die bei Abkühlung zu Eis erstarrt. Der Schmelzpunkt des Eises, 273,15 K, ist der Nullpunkt der Celsius-Temperaturskale. Das Wassermolekül ist gewinkelt gebaut (Bindungswinkel H-O-H 104,5°, Atomabstand 96 pm). Die Bindung im H2O wird zweckmäßig auf der Basis eines Hybridisierungszustandes des Sauerstoffatoms beschrieben, wonach die bindenden Orbitale einen etwas höheren, die die beiden freien Elektronenpaare aufnehmenden Orbitale einen etwas niedrigeren p-Anteil haben, als einer sp3-Hybridisierung entspräche. Die aus der Elektronegativitätsdifferenz zwischen Sauerstoff und Wasserstoff resultierende Bindungspolarität im Sinne Oδ--Hδ+ und die Ver-fügbarkeit freier Elektronenpaare am Sauerstoffatom sind die Ursache für die Ausbildung stabiler Wasserstoffbrückenbindungen zwischen H2O-Molekülen in kondensierter Phase. Diese intermolekulare Wechselwirkung ist bestimmend für die Struktur des festen und flüssigen W.
Wasser. Abb. 1: Struktur des hexagonalen Eises.
Bei Normaldruck kristallisiert W., von dem acht polymorphe Formen bekannt sind, hexagonal in einem dem Tridymit vergleichbaren Gitter (Abb. 1). Am Schmelzpunkt des Eises bricht diese relativ sperrige Struktur weitgehend zusammen, die Packungsdichte der H2O-Moleküle erhöht sich, womit ein Dichteanstieg beim Übergang in die flüssige Phase verbunden ist. Doch auch oberhalb des Schmelzpunktes sind Bruchstücke des Eisgitters erhalten, deren allmählicher Abbau mit steigender Temperatur bei gleichzeitiger Zunahme der Wärmebewegung der H2O-Moleküle das Dichtemaximum des W. bei 4 °C verursacht. Auch im flüssigen
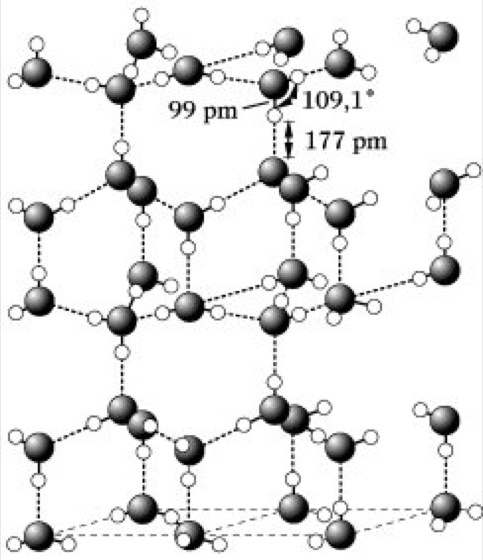
W. ist eine gewisse Struktur nachweisbar, dergestalt, daß H2O-Moleküle durch Wasserstoffbrückenbindungen zu größeren, fluktuierenden, an den Sauerstoffatomen tetraedrisch konfigurierten Aggregaten zusammentreten (Abb. 2). Diese Dichteanomalie des W. hat insbesondere für das biologische Geschehen auf der Erde wesentliche Konsequenzen. Beim Abkühlen natürlicher Gewässer sinkt das dichtere, kältere W. bis zu einer Temperatur von 4 °C nach unten. Bei weiterer Abkühlung verbleibt jedoch das kältere W. an der Oberfläche und erstarrt zu Eis, das infolge der beim Gefrieren erfolgenden Volumenzunahme bzw. Dichteabnahme auf dem flüssigen W. schwimmt. Dieser Umstand und die wärmedämmende Wirkung der Eisschicht verhindern ein Gefrieren tieferer Gewässer bis zum Grund auch bei strengem Frost, was für das Leben in Flüssen und Seen von ausschlaggebender Bedeutung ist. Infolge der Volumenzunahme beim Erstarren des W. platzen gefrierende Wasserleitungen oder werden Gesteine mit Wassereinschlüssen gesprengt. Die starke Vernetzung der H2O-Moleküle im festen und flüssigen W. ist die Ursache der hohen Schmelz- und Verdampfungsenthalpie, die ihrerseits von wesentlichem Einfluß auf die Klimaverhältnisse auf der Erde sind. Die geschilderte Aggregation bewirkt auch den relativ niedrigen Dampfdruck des festen und flüssigen W. und damit den im Vergleich zu den schwereren Chalkogenwasserstoffen unerwartet hohen Schmelz- und Siedepunkt. Auch die hohe Oberflächenspannung und spezifische Wärme sind in diesem Zusammenhang zu sehen.

Wasser. Abb. 2: Zweidimensionale Darstellung der Wechselwirkungen im flüssigen Wasser.
Bindungspolarität und gewinkelter Bau sind die Ursachen des Dipolcharakters des Wassermoleküls. Dieser verschafft W. die außergewöhnlich hohe Dielektrizitätskonstante und die Fähigkeit, polare, insbesondere ionische Verbindungen zu lösen. Dieser Effekt wird verstärkt durch das ebenfalls aus der Dipolnatur resultierende Solvatationsvermögen des W., das sowohl über Donor- als auch Akzeptoreigenschaften verfügt. Somit vermag W. sowohl Anionen als auch Kationen zu solvatisieren, diese zu hydratisieren (Hydratation). Damit im Zusammenhang steht die ausgesprochene Tendenz vieler Verbindungen, in wäßriger Lösung in Ionen zu dissoziieren. Insbesondere kleine, hoch geladene Ionen werden dabei von einer relativ stabilen Hydrathüllc umgeben (Aquakomplexe), die oft auch bei der Kristallisation der Salze aus der wäßrigen Lösung erhalten bleibt (Kristallwasser).
W. verfügt sowohl über Säure- als auch Baseeigenschaften und dient als Standard zur Bestimmung der Säure- und Basestärke (Säure-Base-Konzepte, Brönstedsche Definition). Es unterliegt der Autoprotolyse: H2O + H2O ![]()
H3O+ + OH-; aH3O+· aOH- = Kw = 1·10-14 bei 22 °C (Ionenprodukt).
W. ist eine thermodynamisch ausgesprochen stabile Verbindung. Seine hohe Bildungsenthalpie ist die Triebkraft vieler unter Freisetzung von W. ablaufender Reaktionen. Durch starke Reduktionsmittel, z. B. glühendes Eisenpulver, wird aus W. Wasserstoff entwickelt: H2O + Fe → FeO + H2. Starke Oxidationsmittel, z. B. Fluor, vermögen aus W. Sauerstoff freizusetzen: 2 H2O + 2 F2 → 4 HF + O2. Auch durch Elektrolyse wird W. in Sauerstoff und Wasserstoff gespalten. Mit zahlreichen Nichtmetalloxiden reagiert W. zu Säuren, z. B. SO3 + H2O → H2SO4. Viele Metalloxide werden durch W. in Metallhydroxide übergeführt, z. B. CaO + H2O → Ca(OH)2.
Analytisches. Zum qualitativen Nachweis dienen Salze, die mit W. farbige Hydrate bilden (z. B. reagiert farbloses CuSO4 zu blauem CuSO4·5 H2O oder blaues CoCl2 zu rosafarbenem CoCl2·6 H2O) bzw. durch W. zu farbigen Produkten zersetzt werden (z. B. geht farbloses K[PbI3] in gelbes PbI2, und KI über). Zur quantitativen Analyse des Wassergehaltes von Lösungen eignet sich deren Einwirkung auf ionische oder komplexe Hydride, z. B. auf Calciumhydrid CaH2 oder Lithiumalanat LiAlH4, die mit W. Wasserstoff freisetzen, der gasvolumetrisch bestimmt wird. Eine verbreitete Methode zur Wasserbestimmung bedient sich der Karl-Fischer-Lösung. Daneben kennt man z. T. automatisierte, selbständig registrierende Verfahren, wonach man den Wassergehalt von Gasströmen oder Lösungen anhand der charakteristischen IR-Absorption, mit Hilfe der 1H-NMR-Spektroskopie, (NMR-Spektroskopie), der Gaschromatographie oder auf elektrolytischem Wege ermittelt.
Vorkommen. W. kommt auf der Erde in den drei Aggregatzuständen vor: als festes Polareis, Meereseis und Gletschereis, flüssig als Oberflächenwasser, zu dem man das W. der Meere, Flüsse, Seen, Talsperren u. ä. zählt, und Grundwasser, d. i. das unterirdische Hohlräume ausfüllende W., sowie als Wasserdampf mit einem Anteil von bis zu 4 % in den unteren Atmosphäreschichten. Etwa 71 % der Erdoberfläche sind von W. bedeckt. Das Gesamtvolumen der Weltmeere wird auf 1348·106 km3 geschätzt und entspricht 97,45 % der Wasserreserven der Erde. Nur etwa 2,6 % der Wasservorräte der Erde sind Süßwasser, wovon jedoch mehr als drei Viertel als Polareis und Meereseis einer Nutzung weitgehend entzogen sind. Oberflächenwasser und Grundwasser enthalten stets gelöste Salze, deren Zusammensetzung und Konzentration von der Herkunft des W. abhängt und die die Härte des W. verursachen. Der Salzgehalt des Meerwassers liegt durchschnittlich bei 3,5 %, davon entfallen 2,7 % auf Natriumchlorid. W. mit einem Eindampfrückstand von weniger als 0,1 % wird als Süßwasser bezeichnet. Auch zahlreiche Minerale enthalten W. als Kristallwasser. Neben dem H2O enthält natürliches Wasser stets geringe Anteile von schwerem W. D2O (Deuteriumoxid) und HDO.
Gewinnung. W. entsteht bei der Verbrennung von Wasserstoff sowie als Nebenprodukt bei vielen chem. Reaktionen wie Verbrennungsvorgängen, Neutralisationsreaktionen, Veresterungen, Kondensationen u. a. Gewinnung von W. bezieht sich üblicherweise auf die Reinigung von natürlichem W., wobei die anzuwendenden Verfahren der Wasseraufbereitung von der Verschmutzung des W. und dem Anwendungszweck bestimmt werden. Besonders hochgereinigtes, ultrareines W., z. B. für physikalisch-chem. Messungen, wird durch mehrfache Destillation in Quarz- oder Edelmetallapparaturen unter speziellen Bedingungen gewonnen. In der Pharmazie und im chem. Laboratorium kommt vor allem destilliertes W., aqua destillata, für medizinische Zwecke oft auch bidestilliertes W., aqua bidestillata, zur Anwendung.
Bedeutung, Verwendung. Für das Leben auf der Erde ist das Vorhandensein von Wasser unabdingbare Voraussetzung. Der menschliche Körper besteht zu 60 bis 70 % aus W.; Pflanzen enthalten bis zu 95 %. W. W. ist Grundstoff für die Photosynthese sowie Lösungs- und Transportmittel für Nährstoffe im Organismus wie auch im Boden. Auch die Körpertemperatur von Mensch und Tier wird mit Hilfe des W. reguliert.
Die Anwendungen des W. sind außerordentlich vielgestaltig, entsprechend unterschiedlich sind die Reinheitsanforderungen (Wasseraufbereitung, Wasserversorgung). Trinkwasser, dessen Qualität vor allem hygienischen Ansprüchen genügen muß, wird in den Haushalten vor allem zur menschlichen Ernährung, zum Waschen und für Sanitärzwecke verwendet. Der Bedarf wird für entwickelte Industrieländer mit etwa 150 l je Person und Tag angegeben. In der Industrie kommt W. unterschiedlicher Qualität als Kühl-, Lösungs- und Verdünnungsmittel sowie als Grund- und Hilfsstoff zur Herstellung zahlreicher Produkte zur Anwendung. In der Energiewirtschaft wird es als Energieüberträger, in der Landwirtschaft zur Bewässerung eingesetzt.










Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.