Lexikon der Biologie: Auge
Auge, 1) Botanik: Bezeichnung für noch unentwickelte, ruhende Seitenknospen (vornehmlich in der Sprache des Gärtners; Knospe). Solche Augen sind bei der Veredelung von Nutz- und Zierpflanzen von praktischer Bedeutung. Okulation, Pfropfung. 2) Zoologie: a) Tracht bei Schwanzfedern (Pfauen) oder Schmetterlingsflügeln (Augenfalter, Augenfleck). b)Oculus,Lichtsinnesorgan von unterschiedlichem Aufbau sowie unterschiedlicher Entwicklung (Ontogenese), Abstammung (Phylogenese) und Leistung bei Tieren (und Mensch) und einigen wenigen Algenarten. Die adäquaten Reize (adäquater Reiz) dieser Organe sind elektromagnetische Wellen bestimmter Wellenlängenbereiche (elektromagnetisches Spektrum), wobei kurzwelliges Licht energiereicher ist als langwelliges. Das sichtbare Licht, je nach Art im Bereich von 200 nm–800 nm Wellenlänge, stellt nur einen kleinen Ausschnitt aus dem Gesamtspektrum der elektromagnetischen Wellen dar. Das sichtbare Spektrum erstreckt sich z. B. beim Menschen ungefähr von 380 nm (Violett) bis 750 nm (Rot). Die Energie der Lichtwellen wird in der Regel zur Lichtwahrnehmung von den Sehfarbstoffen absorbiert (Absorption). Diese sind in einzelnen Plasmabezirken oder Zellgruppen (Rezeptorzellen; Rezeptoren) in unterschiedlicher Konzentration lokalisiert, wobei bis zur Sättigung mit zunehmender Konzentration der Sehfarbstoffe eine steigende Lichtempfindlichkeit erreicht wird. Schon bei Einzellern (Protozoen) findet man Hilfsstrukturen, die einfallende Lichtstrahlen auf die Sehfarbstoffe konzentrieren. Meist sind dies blasenartige Ausstülpungen des Plasmas, denen eine Linsenfunktion zukommt. Als Augenflecke oder Stigmen bezeichnet man die im Lichtmikroskop zu erkennenden orangefarbenen Strukturen des lichtempfindlichen Apparates einiger Protozoen (z. B. Euglena;Euglenophyceae). Sie enthalten Lipid-Tröpfchen mit carotinoidhaltigen Pigmenten. Diese Pigmente dienen hauptsächlich der Lichtabsorption und bilden damit einen Schatten auf der lichtabgewandten Seite. Sie sind aber nicht, wie früher vermutet, die eigentlichen Photorezeptoren. Einige Protozoen zeigen präzise Reaktionen auf Licht auch ohne Stigma (z. B. Chlamydomonas, Amöben). Die eigentlichen photosensitiven Strukturen sind an anderer Stelle in der Zelle lokalisiert (z. B. Paraflagellarkörper bei Euglena). Bereits bei den Einzellern und einigen Niederen Mehrzellern besitzen die Sehfarbstoffe (Chromophore) zum Teil unterschiedliche spektrale Empfindlichkeit. Als Sehfarbstoff hat man z. B. Flavine (z. B. bei Euglena) oder Rhodopsine (z. B. bei Chlamydomonas) identifiziert. Sie sind fähig zur Hell-Dunkel-Unterscheidung, d. h. einer Wahrnehmung der Lichtstärke (Helligkeitssehen). Zudem orientieren sich viele dieser Einzeller durch Phototaxis, was eine richtungsspezifische Lichtwahrnehmung voraussetzt.
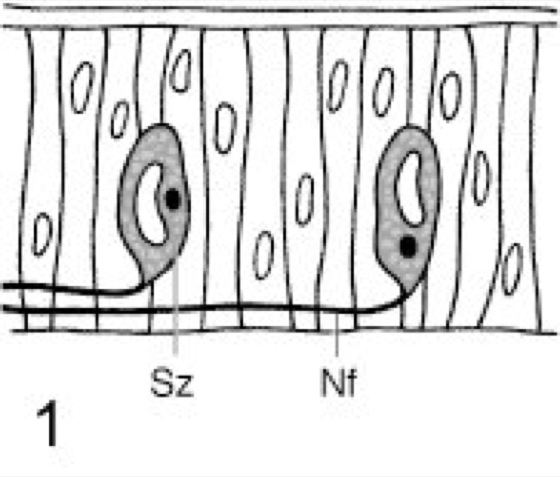
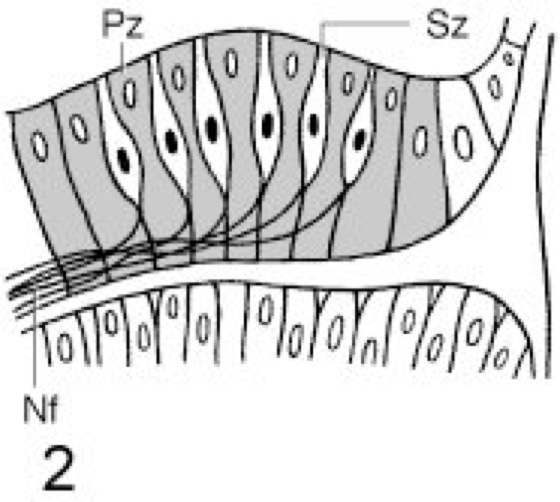
Eine einfache Hell-Dunkel-Wahrnehmung können viele Wirbellose (z. B. Ringelwürmer, Hohltiere, Muscheln, Seewalzen, Seesterne) mit der gesamten Körperoberfläche oder einigen besonders exponierten Körperteilen vollziehen ( vgl. Abb. 1 ), wobei die Lichtwahrnehmung in der Regel durch einzelne Photorezeptoren (Photorezeption) erfolgt (Lichtsinnesorgane). Die einfachen Sehstrukturen der Mehrzeller können über Nervenfortsätze mit dem Nervensystem verbunden sein, wodurch die durch Umweltreize ausgelöste Erregung zu übergeordneten Zentren geleitet und dort ausgewertet und verarbeitet werden kann. – Treten Lichtsinneszellen nicht mehr einzeln, sondern zu Gruppen zusammengefaßt in der Epidermis auf, werden diese als Flachauge oder Plattenauge (z. B. bei Quallen; vgl. Abb. 2 ) bezeichnet. Diese reagieren in manchen Fällen bereits auf Licht verschiedener Wellenlängen wie auch unterschiedlicher Intensitäten. Durch die spezielle Anordnung dieser Sinneszellen in der Epidermis werden diese nur von Licht aus einer bestimmten Richtung erregt, wodurch ein ungefähres Richtungssehen ermöglicht ist. Eine Verbesserung des Richtungssehens ist mit den Becheraugen oder Pigmentbecherocellen möglich, bei denen man nach ihrem Aufbau 2 Typen unterscheidet. Bei den einfachen Becheraugen ( vgl. Abb. 3 ) wird eine Lichtsinneszelle von einer lichtabsorbierenden Pigmentzelle (Pigmente) mehr oder weniger halbkreisförmig umgeben (z. B. bei Lanzettfischchen, einigen Strudelwürmern). Da nur durch die Becheröffnung fallendes Licht die Sinneszelle erregen kann, ist hier ein Richtungssehen möglich. Diese Leistung wird noch verbessert durch die neurale Verrechnung der Erregung mehrerer, unterschiedlich lokalisierter Becheraugen. Diese liegen beim negativ phototaktischen Lanzettfischchen regelmäßig verteilt entlang der Innenseite des Neuralrohrs, ein weiteres Lichtsinnesorgan befindet sich am Vorderende. Bei den zusammengesetzten Becheraugen ( vgl. Abb. 4 ) sind mehrere Sinneszellen von einem absorbierenden Pigmentepithel becherartig umgeben (z. B. bei Strudelwürmern, Blutegel). Durch die Becheröffnung einfallendes Licht erzeugt in Abhängigkeit von seiner Einfallsrichtung ein spezifisches Erregungsmuster verschiedener Sinneszellen. Dadurch ist nur mit einem Becherauge die Lokalisation einer Lichtquelle möglich. – Die nächsthöhere Entwicklungsstufe stellen die Grubenaugen oder Napfaugen ( vgl. Abb. 5 ) einiger Schnecken dar. Bei diesen ist eine grubenförmig gestaltete Sehzellenschicht körperwärts von lichtundurchlässigen Pigmenten abgeschirmt. Diese können ein eigenes Epithel bilden oder Bestandteil der Sehzellenschicht sein. Da einfallende Lichtstrahlen stets eine Gruppe von Sinneszellen gleichmäßig erregen, aber kein differenziertes Erregungsmuster erzeugen, ist mit diesem Augentyp ein gutes Richtungssehen, aber kein Bildsehen möglich. Für eine Gegenstandsabbildung auf der Rezeptorenschicht ist Voraussetzung, daß die von verschiedenen benachbarten Punkten eines Gegenstands ausgehenden Lichtstrahlen auch entsprechende benachbarte Sinneszellen anregen. Dies wird bei dem Lochkameraauge oder Lochauge (bei Nautilus; vgl. Abb. 6 ) erreicht, einer Weiterentwicklung des Grubenauges, das auch nach dem Prinzip der Camera obscura arbeitet. Dabei wird die Grube zu einer blasenförmigen Einstülpung mit einem Sehzellenepithel (Netzhaut oder Retina). Die Grubenöffnung verengt sich zu einem kleinen Sehloch. Ein Gegenstand erscheint somit auf der Netzhaut als lichtschwaches, kleines, umgekehrtes Bild, dessen Schärfe proportional der Anzahl der erregten Sinneszellen ist. Da die Menge der erregten Rezeptoren darüber hinaus mit dem Abstand Gegenstand–Sehloch korreliert ist, ermöglicht dieser Augentyp bereits ein bedingtes Entfernungssehen. – Nach demselben Prinzip, jedoch mit verbesserter Leistung, arbeitet das Blasenauge ( vgl. Abb. 7 ; vgl. Abb. [Photo] ). Es entsteht durch eine blasenartige Einstülpung der Epidermis, die mit einem Pigmentepithel und einer Sehzellenschicht ausgekleidet ist. Mit diesen Augen (bei Hohltieren, Schnecken, Ringelwürmern) ist in Abhängigkeit von dem Durchmesser der Sehöffnung ein lichtstärkeres, aber unscharfes, oder ein lichtschwächeres, aber scharfes Bildsehen möglich. Eine Leistungsverbesserung wird bei einigen Schnecken erreicht, indem die Augenblase mit einem lichtdurchlässigen Sekret ausgefüllt wird. Diesem kommt eine Linsenfunktion zu, deren Wirkung jedoch begrenzt ist, da das Sekret nicht akkommodieren (Akkommodation) kann.
Ein gänzlich anderer Augentyp, das Komplexauge oder Facettenauge ( vgl. Abb. 9 ), ist bei den Insekten und Krebstieren, aber auch bei ursprünglichen Tausendfüßern (Hundertfüßer, Scutigera) und Arachnata (Trilobiten und Limulus) anzutreffen. Komplexaugen bestehen aus Einzelaugen, den Ommatidien, deren Anzahl bis zu 28 000 (bei Libellen) je Auge betragen kann. Jedes Ommatidium besitzt einen lichtbrechenden Apparat und einen proximalen rezeptorischen Teil. Jede Sehzelle (Retinulazelle) weist je ein ableitendes Axon auf. Im häufigsten Fall liegen 8 Retinulazellen kreisförmig beieinander, wobei ihre lichtsensitiven Bereiche (Rhabdomere) nach innen gerichtet sind und einen zentralen Sehstab (Rhabdom) bilden. Beim Appositionsauge, das vor allem bei tagaktiven Insekten zu finden ist, ist jedes Einzelauge mehr oder weniger vollständig durch Pigmentzellen gegenüber den Nachbarommatidien isoliert. Es ist wenig lichtempfindlich, hat aber eine gute räumliche Auflösung, d. h. Sehschärfe. Das neurale Superpositionsauge der Zweiflügler (Dipteren) ähnelt im Aufbau einem Appositionsauge, jedoch fusionieren die Rhabdomere nicht zu einem Rhabdom. Die optischen Achsen der einzelnen Rhabdomere in einem Ommatidium divergieren leicht. Als Folge hiervon aktiviert paralleles Licht nur je eine Retinulazelle in mehreren benachbarten Ommatidien, wobei die Axone dieser aktivierten Retinulazellen auf dasselbe nachgeschaltete Neuron konvergieren. Dagegen finden sich in den Superpositionsaugen bei nachtaktiven Insekten verkürzte Pigmentzellen zwischen den Ommatidien, so daß Licht seitlich in mehrere Einzelaugen gelangen kann. Hier geht eine erhöhte Lichtsensitivität auf Kosten der räumlichen Auflösung. Da sich im Komplexauge die Gesichtsfelder der Einzelaugen nur wenig überschneiden und die einzelnen Ommatidien nicht akkommodieren können, ist dessen räumliches Auflösungsvermögen begrenzt. Abzubildende Gegenstände werden in Einzelpunkte zerlegt und müssen neural wieder zu einem Ganzen zusammengefügt werden. Eine Verbesserung der Sehschärfe wird jedoch durch das hohe zeitliche Auflösungsvermögen der Komplexaugen erreicht. Durch rasches optisches Abtasten der Umgebung können viele Details erfaßt und zu Formen zusammengefügt werden. Das Spektrum des für Komplexaugen sichtbaren Lichts (300–650 nm) ist im Gegensatz zum Säugerauge zum UV (Ultraviolett) hin verschoben (Bienenfarben) oder insgesamt erweitert, da manche Insekten (einige Tagfalter) zusätzlich auch Rotwahrnehmung besitzen (Farbensehen). Eine besondere Leistung liegt in der Wahrnehmung der Polarisationsmuster des Tageslichts (Polarisationssehen). Das Sonnenlicht ist unpolarisiert, d. h., seine elektrischen Feldvektoren schwingen in allen Richtungen senkrecht zur Ausbreitungsrichtung des Lichts. Moleküle in der Erd-Atmosphäre streuen (Streuung) das Sonnenlicht derart, daß die Feldvektoren in einem spezifischen Polarisationsmuster (in konzentrischen Kreisen um die Sonne) angeordnet werden. Dieses Muster verändert sich mit dem Sonnenstand. Durch Erkennen des dem jeweiligen Sonnenstand zugehörigen Polarisationsmusters sind diese Tiere in der Lage, sich auch bei bedeckter Sonne, allein mit Hilfe eines Fleckens blauen Himmels, an deren Stand zu orientieren (Kompaßorientierung). Als die am weitesten differenzierten Augen, neben den Komplexaugen, gelten die Linsenaugen. Sie sind in der Evolution mehrmals entstanden (Konvergenz). Man findet einfache Typen schon bei Hohltieren (z. B. bei der Scyphomeduse Nausithoe;Scyphozoa), räuberischen Ringelwürmern, bei einigen Insektenlarven sowie dem Wasserfloh Labidocera, bei Weichtieren und Spinnen. Erwähnenswert sind z. B. die Linsenaugen der Kammuschel Pecten, von denen ca. 100 am Mantelrand verteilt sitzen. In den ca. 1 mm großen Augen sitzen Linse und Netzhaut sehr nahe beieinander, so daß die Brechkraft (Brechungsindex) der Linse nicht ausreicht, um direkt ein scharfes Bild auf der Netzhaut zu erzeugen. Erst nach Reflexion an der halbkreisförmigen Pigmentschicht entsteht am distalen Netzhautteil das umgekehrte, scharfe Bild. Als einzige Arthropodengruppe besitzen die Chelicerata Linsenaugen anstatt Komplexaugen (Ausnahme: Limulus). Im allgemeinen findet man am Vorderende 1 Paar median liegende Hauptaugen und 2–3 Paar seitlich liegende Nebenaugen. Die Vertreter der kleinen Springspinnen erreichen mit ihren relativ großen Medianaugen eine hohe Auflösung (bis zu 0,1°) und besitzen 6 Augenmuskeln, welche die Netzhaut verschieben und somit, trotz einer unbeweglichen Linse, auch bei verschiedenen Objektentfernungen ein scharfes Bild erzeugen können.
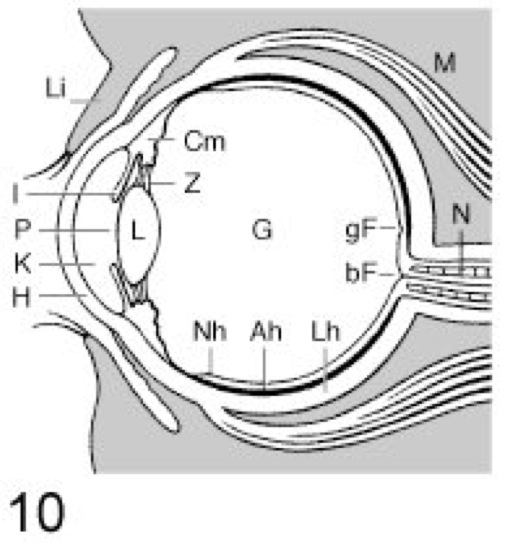
Die leistungsfähigsten Lichtsinnesorgane stellen die Linsenaugen der Kopffüßer ( vgl. Abb. 8 ) und Wirbeltiere ( vgl. Abb. 10 ) dar. Bei beiden Gruppen stimmen die Augen in Funktion und Aufbau im wesentlichen überein, zeigen aber eine unterschiedliche Entwicklung und sind von daher konvergente Bildungen (Konvergenz). Das Wirbeltierauge besteht aus dem radiärsymmetrischen Augapfel und den Hilfseinrichtungen, die der Bewegung und dem Schutz des Auges dienen (Muskel, Lid, Drüsen). Der Augapfel enthält den dioptrischen Apparat, ein zusammengesetztes Linsensystem, bestehend aus Hornhaut (Cornea), Regenbogenhaut oder Iris, Linse und Glaskörper. Er wird von außen nach innen ausgekleidet durch die Lederhaut (Faserhaut), Aderhaut (mit Pigmentzellen) und Netzhaut. Die Netzhaut stellt die sensorische Empfangsfläche des Auges dar und ist von außen nach innen aus den Schichten der Photorezeptoren, der Bipolarzellen (zusammen mit amakrinen Zellen und Horizontalzellen) und der Ganglienzellen sowie Blutgefäßen und Gliazellen (Glia) aufgebaut. Die Gliazellen sind für die Aufrechterhaltung eines konstanten Ionenmilieus zuständig. Die Axone der Ganglienzellen vereinigen sich innerhalb der Netzhaut am blinden Fleck, um dort als Sehnerv (Nervus opticus; Opticus), den Augapfel nach hinten durchdringend, zu den höheren visuellen Sehzentren des Gehirns zu ziehen. Die Fasern des Sehnervs verlaufen entlang des Augenstiels zur Basis des Zwischenhirns und überkreuzen sich dort teilweise (Chiasma opticum). Hierdurch werden die Bilder beider korrespondierenden Netzhauthälften im visuellen Cortex übereinander projiziert, so daß es zu einer räumlichen Tiefenwahrnehmung kommt (binokulares Sehen;Entfernungssehen). Dies ist nur in dem Bereich möglich, der von beiden Augen gleichzeitig überblickt werden kann, und ist damit abhängig von der Stellung der Augen im Kopf. Der dioptrische Apparat des Linsenauges entwirft ein verkleinertes, umgekehrtes Bild auf der Netzhaut. Die dabei eingestrahlte Lichtenergie bewirkt eine Konfigurationsänderung oder Spaltung (bei Wirbeltieren) der in den Photorezeptoren befindlichen Sehfarbstoffe. Dieser photochemische Vorgang löst eine Potentialänderung im Photorezeptor aus (Hyperpolarisation bei Wirbeltieren), die über die Bipolarzellen letztlich ein Aktionspotential in der nachgeschalteten Ganglienzelle verursacht. Über die Axone des Sehnervs wird die Erregung zu den im visuellen Cortex nachgeschalteten Zentren weitergeleitet. Die meisten Wirbeltiere besitzen 2 verschiedene Typen von Photorezeptoren (Duplizitätstheorie des Sehens; Kries [J.A. von]): 1) die weniger lichtempfindlichen Zapfen (Netzhaut). Von diesen gibt es beim Menschen 3 Arten mit unterschiedlicher spektraler Empfindlichkeit. Sie dienen dem Tagessehen (photopisches Sehen) und Farbensehen. Sie sind über die gesamte Netzhaut verteilt und erreichen ihre größte Dichte an der Stelle des schärfsten Sehens im Zentrum der Netzhaut (Fovea centralis). 2) Die sehr lichtempfindlichen Stäbchen sind hauptsächlich in der Netzhautperipherie lokalisiert und fehlen ganz in der Fovea. Mit diesen ist nur ein Hell-Dunkel-Sehen möglich, und sie dienen somit dem Dämmerungssehen (skotopisches Sehen) und Nachtsehen. Beim Wechsel von Tag- zum Dämmerungssehen ändert sich der spektrale Empfindlichkeitsbereich, da das Optimum des Zapfensystems bei ca. 550 nm liegt und das der Stäbchen bei ca. 510 nm (Purkinje-Verschiebung, Purkinje-Phänomen). Von der Sehzellendichte der Netzhaut und dem Verhältnis Stäbchen/Zapfen sind die Sehschärfe und die Fähigkeit zum Tag- oder Nachtsehen abhängig. Um in beliebigen Entfernungen liegende Gegenstände scharf auf der Netzhaut abzubilden, muß sich der dioptrische Apparat des Auges auf die verschiedenen Gegenstandsweiten einstellen. Diesen Vorgang nennt man Akkommodation (Akkommodationsbreite). Die entsprechende Einstellung wird durch die innere Augenmuskulatur bewirkt, wobei entweder durch Linsenverschiebung (z. B. bei Fischen, Amphibien und Schlangen) eine Bildweitenänderung erfolgt oder der Krümmungsradius der Linse und damit deren Brennweite verändert wird (z. B. bei Reptilien außer Schlangen, Vögeln und Säugern).
Eine weitere besondere Leistung des Wirbeltierauges liegt in dessen Anpassungsfähigkeit an extrem unterschiedliche Helligkeitsstufen. Die Lichtintensitäten zwischen gerade noch wahrnehmbarem Licht und hellem Sonnenlicht verhalten sich wie 1 : 1010 Die Fähigkeit des Auges, sich auf die jeweilige Lichtintensität einzustellen, wird als Adaptation (Hell-Dunkel-Adaptation) bezeichnet. Das Auge behält dadurch eine konstant hohe Lichtempfindlichkeit – unabhängig von der jeweiligen Beleuchtung. Diesem Vorgang liegen bei den Wirbeltieren im wesentlichen folgende Mechanismen zugrunde: Veränderung der Pupillenöffnung (Pupille, Pupillenreaktion), unterschiedliche Lichtempfindlichkeit von Stäbchen und Zapfen, unterschiedliche Lichtempfindlichkeit der Photorezeptoren in Abhängigkeit von der vorhergegangenen Beleuchtung, verschiedene photochemische Verstärkereffekte und Reaktionsgeschwindigkeiten der Sehfarbstoffe in Abhängigkeit von der Lichtintensität. Fische besitzen darüber hinaus noch die Fähigkeit, ihre Photorezeptoren in das Pigmentepithel des Augenhintergrundes zu ziehen (Retinomotorik). Außerdem spielen verschiedene neurale Mechanismen in höheren visuellen Hirnzentren eine wichtige Rolle bei der Adaptation. Abducens, Abwehrauge, Anblicken, Argentea, Augenbecher, Augenbewegungen, Augenempfindlichkeit, Augenleuchten, Augenlinse, Augenmuskeln, Augenpigmente, Augenspiegel, Bewegungssehen, Bewegungswahrnehmung, Bildwahrnehmung, Bindehaut, Bionik, Blickfeld, Blickkontrollzentren, Blindheit, Chamäleons, Farbenfehlsichtigkeit, Induktion, Kammerwasser, Lid, Linsenproteine, Linsenregeneration, Lobus opticus, Modalität, Mongolenfalte, Nachtblindheit, Nervensystem, Nystagmus, Oculomotorius, Rindenfelder, Tapetum, Trochlearis.
H.W./F.St.
Lit.:Hubel, D.H.: Auge und Gehirn. Neurobiologie des Sehens. Heidelberg 1990. Röhler, R.: Sehen und Erkennen. Psychophysik des Gesichtssinnes. Berlin 1995. Mallot, H.A.: Sehen und die Verarbeitung visueller Information. Eine Einführung. Wiesbaden 1998. Shilo, S.: Vom Licht zur Sicht. Die Evolution des Sehens. Thun – Frankfurt a.M. 1996.















Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.